Classificação do remodelamento do VD
Fica claro que para avaliar corretamente a função ventricular direita quando se produz remodelamento, não bastam os parâmetros convencionais de função e de deformação, mas a determinação do tipo de remodelamento nos diversos tipos de sobrecarga.
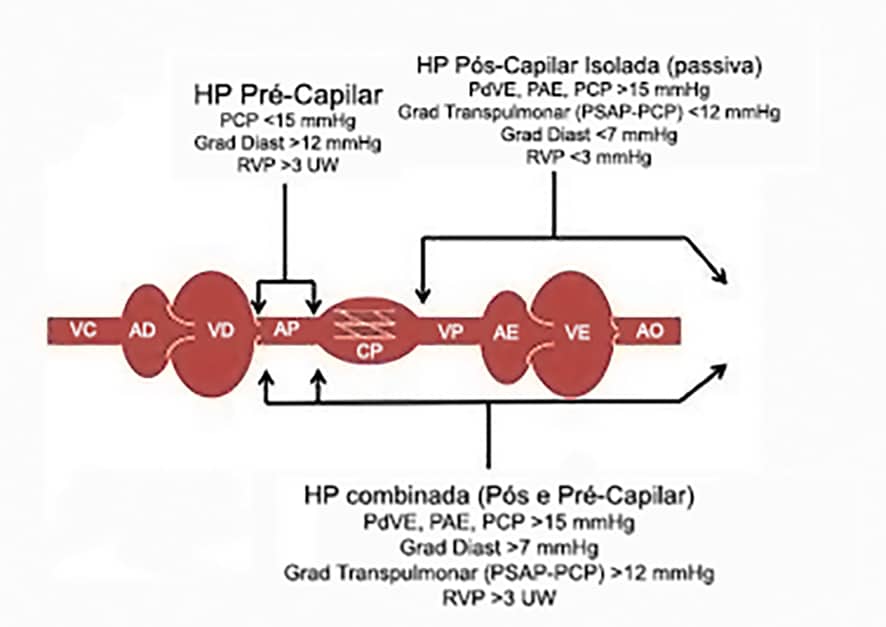
O tipo mais frequente de sobrecarga ventricular direita é a HAP pós-capilar, com pressão capilar pulmonar (PCP) >15 mmHg, devida à sobrecarga pressórica provocada por valvopatias ou cardiomiopatias do coração esquerdo, em geral de caráter crônico.
A HAP pré-capilar (PCP<15 mmHg) resulta do remodelamento da vasculatura pulmonar que determina aumento da resistência vascular pulmonar, como ocorre em doenças que afetam o pulmão, na hipertensão pulmonar primária, no tromboembolismo pulmonar crônico, e devido a causas multifatoriais, sendo importante destacar neste grupo a forma que acompanha a esquistossomose mansônica do tipo hepato-esplênica (1).
Recentemente foi identificado um fenótipo misto, que combina HAP pré-capilar e pós-capilar, baseado no gradiente diastólico pulmonar e na resistência vascular pulmonar (RVP), que pode ocorrer em pacientes com disfunção sistólica e diastólica do VE onde há profundo remodelamento arteriolar pulmonar, com hipertrofia da média e espessamento da íntima (2). A Tabela abaixo mostra a classificação homologada pela OMS (3).

Como a adaptação do VD ao aumento da pós-carga é a causa determinante da HAP, a RVP (que mede a resistência oferecida à passagem do fluxo pelo sistema circulatório pulmonar (4)) e a complacência do sistema arterial pulmonar (C) quantificam as propriedades resistivas e elásticas respectivamente (5). Nos casos de HAP é importante, portanto, determinar a RVP.
Do ponto de vista hemodinâmico, a RVP pode ser definida como o quociente entre o gradiente pressórico transpulmonar e o débito pulmonar (6):
RVP = PSAP – PCP / Qp
Onde PSAP: pressão sistólica da artéria pulmonar; PCP: pressão capilar pulmonar; Qp: débito pulmonar.
Abbas e col (7) propuseram um método para o cálculo da RVP utilizando a ecocardiografia Doppler, onde:
RVP = VRT / VTIVSVD x 10 + 0,16
Onde VRT é a velocidade de refluxo tricúspide, que corresponde ao gradiente pressórico transpulmonar e VTIVSVD é a integral da velocidade do fluxo da via de saída do VD, que corresponde ao débito pulmonar. Quando comparada com a RVP estimada pela hemodinâmica, o autor obteve uma excelente correlação, com R=0,929.
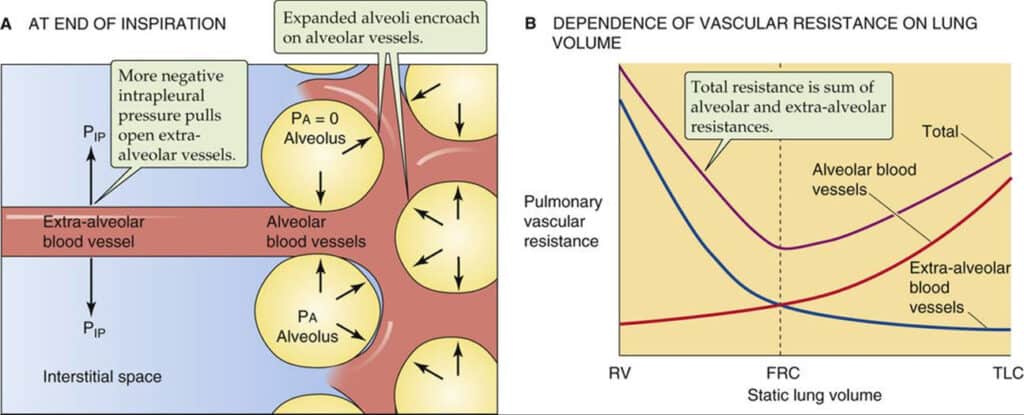
Este cálculo, entretanto, pode ser influenciado pela variação da pressão alveolar e pelo volume pulmonar durante o ciclo respiratório, o que torna o cálculo da RVP relativamente impreciso, embora útil para determinação genérica do estado da circulação pulmonar (8). A figura 15 ilustra o efeito da pressão alveolar e do volume pulmonar.
Uma classificação mais simplificada da HAP encontra-se na Tabela abaixo (9).

Entre as sobrecargas volumétricas sem aumento significativo da pressão pulmonar temos a CIA, a insuficiência tricúspide e a insuficiência pulmonar, mas é importante lembrar que todas estas patologias podem desenvolver HAP reacional.
Metodologia de avaliação do remodelamento e função do VD
O remodelamento do VD pode ser avaliado pela ressonância magnética pela relação entre o volume e a massa da cavidade, mas fica fora do alcance da ecocardiografia convencional.
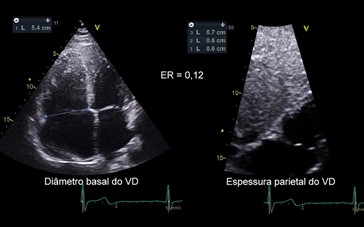
Uma forma simplificada, análoga ao método utilizado no VE, é calcular a espessura relativa, obtida pelo quociente entre a espessura diastólica da parede e o diâmetro basal do VD (10). A espessura da parede do VD é obtida pelo corte subcostal, estimando-se a média de 3 medições. O diâmetro basal do VD é obtido desde a posição apical de 4 câmaras ao nível do anel tricúspide (Figura 16).
A sobrevida de pacientes portadores de HAP está relacionada com o remodelamento reverso do VD após iniciado o tratamento. O remodelamento reverso consiste na diminuição das dimensões e melhora dos parâmetros de função, podendo ser estimado como uma diminuição >15% da área sistólica obtida desde a posição de 4 câmaras após o início do tratamento.
Espessura relativa do VD >0,21 é preditor independente de remodelamento reverso, menor incidência de complicações e maior sobrevida, indicando que o aumento de espessura das paredes contribui para a redução do estresse sistólico parietal. Esta regra é válida quando há sobrecarga pressórica do VD, pois o valor normal da espessura relativa foi estimado em 0,16±0,02 (11).
Para identificar o remodelamento deve-se analisar cada tipo de alteração em particular, sendo recomendada a realização de cateterismo cardíaco para identificar a HP, pois a ecocardiografia pode apresentar sensibilidade inferior para este propósito:
HAP pós-capilar. Este tipo de HAP é devida a doenças do coração esquerdo que elevam a pressão diastólica final do VE, a pressão do átrio esquerdo (AE), a pressão venosa e, por consequência, a PCP a valores superiores a 15 mmHg. Este aumento da PCP desencadeia um processo de vasoconstrição das arteríolas pulmonares pré-capilares com a finalidade de proteger o sistema capilar, motivo pelo qual a pressão pulmonar se eleva gradativamente, provocando remodelamento do VD. Há dilatação e hipertrofia do VD com dilatação anular tricúspide e consequente insuficiência valvar. A RVP, entretanto, é normal. É a forma mais frequente de HP e corresponde ao grupo 2 da OMS.
HAP combinada (pré-capilar e pós-capilar). Observa-se em pacientes que apresentam doença do coração esquerdo e remodelamento vascular pulmonar secundário à congestão crônica. Também pode ocorrer em pacientes com HP muito hipervolêmicos com deslocamento para a esquerda do septo interventricular que provoca aumento de pressão do AE e, consequentemente, da PCP (12). Também acomete pacientes do grupo 2 da OMS.
HAP pré-capilar crônica. Ocorre em pacientes do grupo 1 da OMS, com HP idiopática, hereditária, por infecção pelo HIV, por doenças do tecido conectivo, hipertensão portal, drogas ou doenças congênitas, assim como a doença oclusiva veno-pulmonar crônica, hemangiomatose capilar pulmonar e devida à esquistossomose. A PCP é <15 mmHg e não há doença pulmonar significativa nem tromboembolismo pulmonar crônico. Cursam com vasoconstrição arteríolar, remodelamento vascular com lesões plexiformes e microtroboses. Também ocorre em pacientes do grupo 3 da OMS, acometidos por doenças pulmonares e/ou hipóxia (DPOC, doença pulmonar intersticial, apneia do sono, altas altitudes).
HAP pré-capilar aguda e subaguda. Corresponde a pacientes do grupo 4 da OMS com tromboembolismo pulmonar subagudo ou crônico, arterite pulmonar obstrutiva, tumores ou estenose congênita da artéria pulmonar.
Na Figura 17 se ilustra esta fisiopatologia.
Remodelamento do VD sem HAP significativa. Em pacientes portadores de CIA, insuficiência tricúspide e insuficiência pulmonar ocorre remodelamento do VD devido à sobrecarga volumétrica da cavidade que não desenvolvem HP significativa, mas que, por causa do aumento das dimensões da cavidade, há um processo de hipertrofia ventricular com o objetivo fisiológico de diminuir o estresse parietal. Estes pacientes apresentam os parâmetros de função sistólica do VD normais (variação de áreas, TAPSE, onda s’ do anel tricúspide e strain longitudinal da parede lateral).
O remodelamento, entretanto, manifesta-se pelo aumento da mecânica radial (13) (aumento do strain radial ou transversal do VD), sendo a relação entre espessura e tamanho da cavidade (espessura relativa) a determinante da evolução clínica.
Na próxima parte abordaremos os parâmetros utilizados para a avaliação da função do VD pela ecocardiografia e seus valores de referência.
Referências bibliográficas.
1- Castillo JM, Bandeira AMP, Albuquerque ES, et al. Echocardiography of right ventricle in patients with schistosomiasis-induced pulmonary hypertension. Arq Bras Cardiol Imagem Cardiovasc 2016; 29(3):84-91.
2- Charalampopoulos A, Lewis R, Hickey P, et al. Pathophysiology and diagnosis of pulmonary hypertension due to left heart disease. Front Med 2018; 5:174.
3- Leopold JA, Maron BA. Molecular mechanisms of pulmonary vascular remodeling in pulmonary arterial hypertension. Int J Mol Sci 2016; 17:761.
4- Chamarthy MR, Kandathil A, Kalva SP. Pulmonary vascular pathophysiology. Cardiovasc Diagn Ther 2018; 8(3):208-213.
5- Chemla D, Lau EMT, Papelier Y, et al. Pulmonary vascular resistance and compliance relationship in pulmonary hypertension. Eur Respir J 2015; 46:1178-1189.
6- Boschilia T, Capuano RL, Moraes MA, et al. Resistência vascular pulmonar em pacientes com hipertensão pulmonar. Utilização da prova de oxigênio e avaliação pela ecocardiografia Doppler. Rev Bras Ecocardiogr 2007; 20(3):22-27.
7- Abbas AE, Fortuin FD, Schiller NB et al. A simple method for noninvasive estimation of pulmonary vascular resistance. J Am Coll Cardiol 2003; 41:1021-1027.
8- Boron W, Boulpaep E. Perfusion of the Lung. Medical physiology, 3rd Edition 2016.
9- Humbert M, Montani D, Evgenov OV, Simonneau G. Definition and classification of pulmonary hypertension, Pharmacotherapy of pulmonary hypertension. In Handbook of experimental pharmacology. Springer-Verlag, Berlin Heildelberg 2013, DOI 10.1007/978-3-642-38664-0_1.
10- Sano H, Tanaka H, Motoji Y, et al. Right ventricular relative wall thickness as a predictor of outcomes and of right ventricular reverse remodeling for patients with pulmonary hypertension. Int J Cardiovasc Imaging 2016; 33(3):313-321.
11- Castillo JM, Oliveira KB, Bandeira AMP, et al. Identificação do padrão de remodelamento ventricular direito e sua relação com a capacidade funcional e prognóstico. Resultado parcial de estudo em execução.
12- Calderaro D, Alves Jr JL, Fernandes CJCS, Souza R. Hipertensão pulmonar na prática do cardiologista. Arq Bras Cardiol 2019; 113(3):419-428.
13- Castillo JM, Albuquerque ES, Silveira CAM et al. Right ventricle: Echocardiographic evaluation of pressure and volume overload. Rev Argent Cardiol 2016; 84:581-587.

É doutor em medicina, especialista em Cardiologia (SBC) e especialista em Ecocardiografia.
Curriculum completo disponível na Plataforma Lattes
(http://lattes.cnpq.br/4922446519082204)