A cardiomiopatia hipertrófica apical (CMPH Apical) é o fenótipo correspondendo por cerca de 38% dos casos de CMPH em asiáticos e em torno de 2.8-8% na população ocidental.
Já está bem documentado na literatura que metade dos pacientes com este fenótipo pode apresentar um caráter progressivo de alterações morfológicas e até 1/3 desses pacientes pode evoluir com eventos cardíacos adversos, tais como disfunção ventricular progressiva, fibrilação atrial e morte por causa cardíaca.
Conceitualmente, a CMPH apical é aquela em que há aumento inexplicado da espessura diastólica da região apical do VE ≥ 15 mm. Este achado pode ser classificado em alguns subtipos, como a CMPH Apical pura em que a hipertrofia é restrita aos segmentos apicais (após o nível dos músculos papilares) e CMPH Apical mista, cuja hipertrofia também pode acometer segmentos médios (antes do nível dos músculos papilares.
Já a CMPH Apical relativa é caracterizada pela presença de ondas T invertidas no eletrocardiograma, com a espessura diastólica da região apical sendo maior que a da região basal, porém sem fechar o critério de 15 mm. Pode-se considerar um subtipo precoce da CMPH apical e que pode apresentar evolução ao longo do tempo.
Se você já frequenta este blog há algum tempo, já deve ter lido algumas publicações falando sobre a importância da ponta do ventrículo esquerdo (VE) para a mecânica cardíaca, através do mecanismo de torção cuja atuação confere maior eficiência contrátil com menor gasto energético.
Ora, se temos aqui uma condição patológica que afeta a região apical do VE e se temos como avaliar o comportamento da mecânica contrátil dessa região através do strain, então o que devemos esperar dos achados relacionados à rotação ventricular esquerda na MCPH apical ???

Estudo com 134 pacientes portadores de CMPH Apical avaliados entre agosto de 2020 e março de 2023 em um centro universitário na China. Desses, 119 foram submetidos à ecocardiografia com contraste e/ou ressonância magnética (RM) cardíaca.
Pacientes com fibrilação atrial (n = 3), defeito do septo interventricular (n = 1), passado de ablação alcoólica (n = 1) e janela ecocardiográfica desfavorável (n = 10) foram excluídos do estudo.
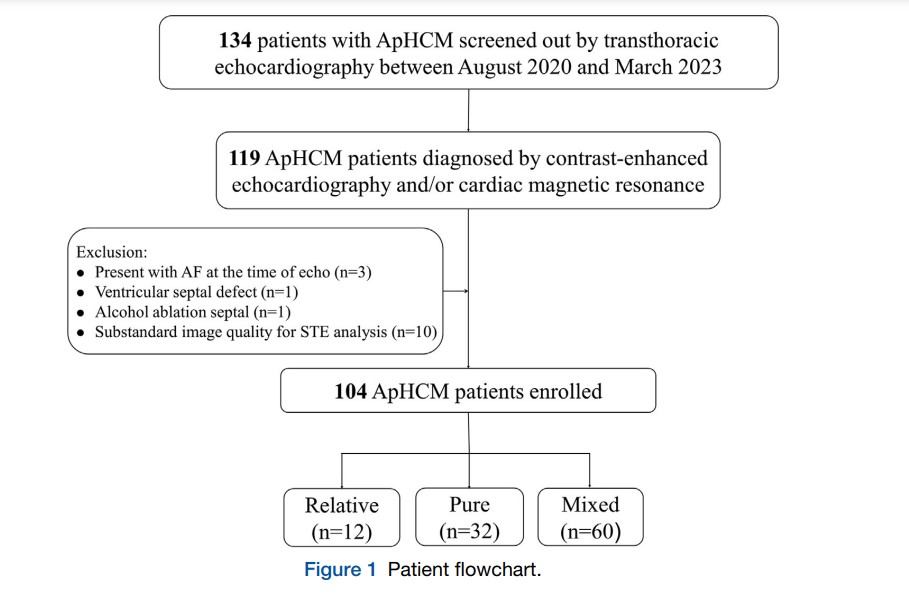
Foram avaliados, portanto, 104 pacientes e comparados com um grupo controle composto por 30 indivíduos saudáveis e pareados por idade e sexo. Dentre os participantes, 12 apresentavam o subtipo relativo da CMPH Apical, 32 o fenótipo puro e 60, o misto.
A idade média dos pacientes foi de 52 ± 12 anos, com 80% dos participantes sendo do sexo masculino. Os pacientes com CMPH Apical apresentaram maiores valores de pressão arterial, bem como de superfície corpórea. Não houve, porém, diferenças na pressão arterial ou superfície corpórea (SC) entre os subgrupos da CMPH Apical.
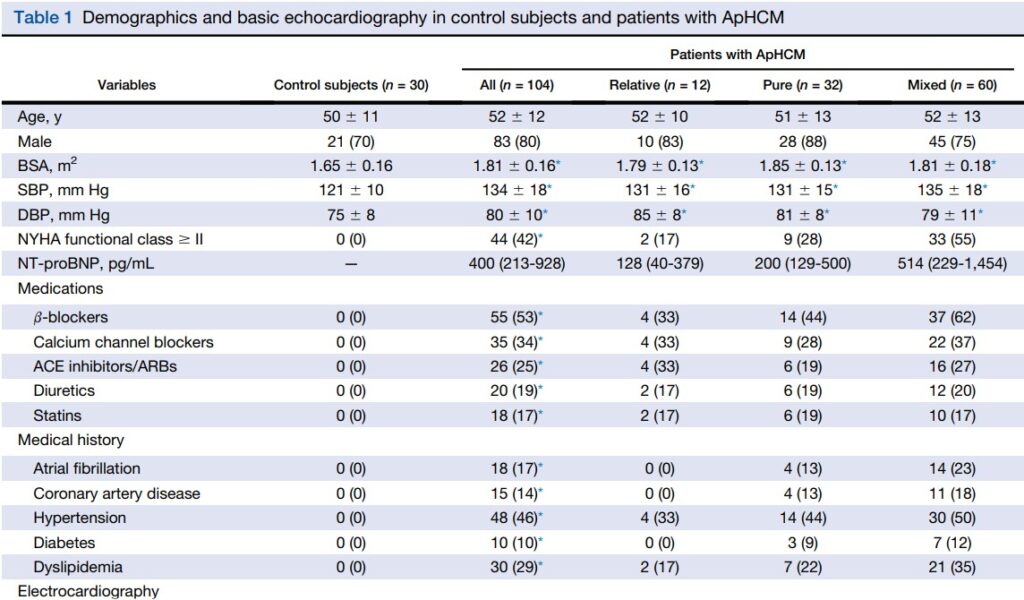
Os pacientes com CMPH Apical tiveram (obviamente !) maior espessura diastólica máxima da região apical do VE (16.8 ± 2.9 x 8.5 ± 0.7, P < 0.001) e menos volumes desta cavidade. Ainda, como esperado, tanto a relação E/e´ e o volume indexado do átrio esquerdo (AE) foram maiores nesses pacientes comparados com o grupo controle.
Dentre os 104 pacientes com CMPH Apical, a relação média de obliteração do VE foi de 0.50 e 16 pacientes tinham aneurisma na região apical do ventrículo esquerdo. 13 participantes tinham obstrução médio ventricular, sendo todos portadores do subtipo misto de CMPH Apical. Nenhum participante apresentou obstrução da via de saída do VE.
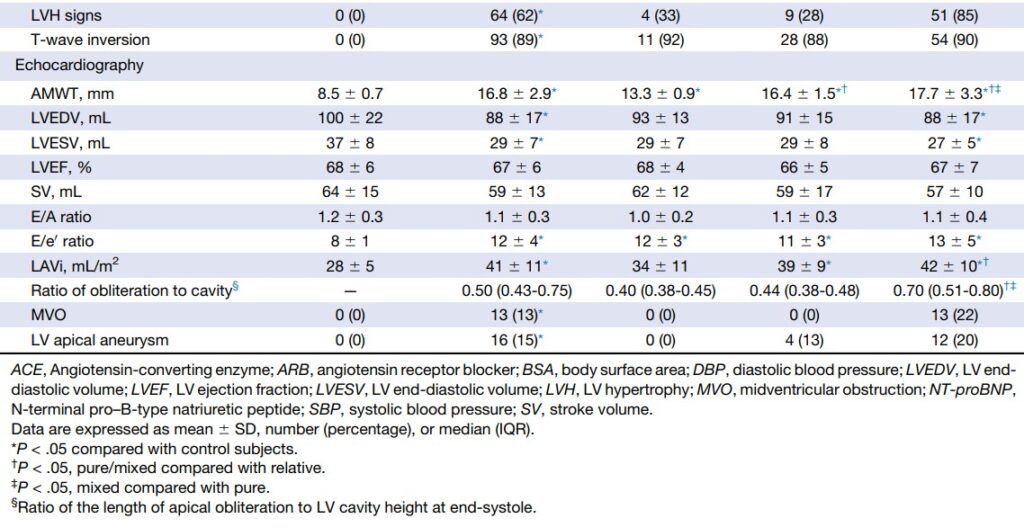
Comparado com o grupo controle, pacientes com CMPH Apical demonstraram redução do strain apical digna de nota:
- Strain longitudinal: 10.8 ± 4.6% x 20.0 ± 1.7%, P < 0.001;
- Strain circunferencial: 15.9 ± 5.3 x 25.6 ± 3.7%, P < 0.001;
- Strain radial: 16.0 ± 9.2 x 35.6 ± 11.1%, P < 0.001).
Além disso, apresentaram redução da rotação apical (9.3 ± 3.8 graus x 13.2 ± 3.8 graus, P < 0.001) e do twist global (19.1 ± 3.9 graus x 22.6 ± 2.7 graus, P < 0.001). Notadamente, houve um discreto aumento (compensatório ??) da rotação basal.
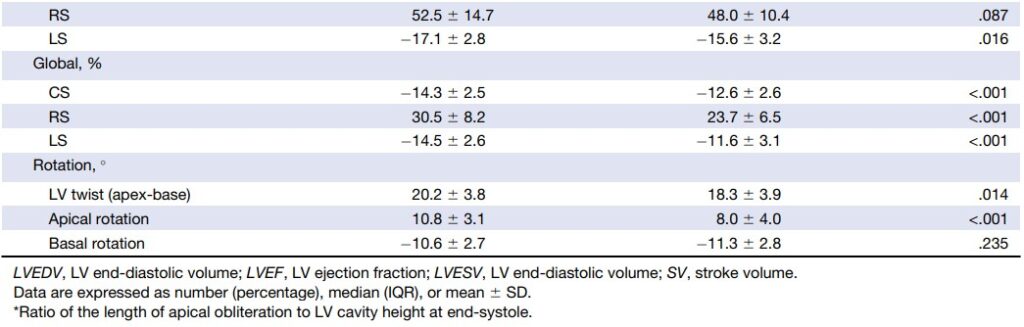
Ainda, foi observado uma diminuição significativa do strain radial (41.6 ± 17.8% x 55.4 ± 12,3%, P < 0.001) e do valor absoluto do strain longitudinal (12.9 ± 3.6% x 18.1 ± 2.0 %, P , 0.001) no plano médio ventricular, enquanto que o strain circunferencial (19.0 ± 3.8% x 20.1 ± 3.2%, P = .0223) permaneceu preservado. Adicionalmente, houve redução significativa do strain longitudinal nos segmentos basais.
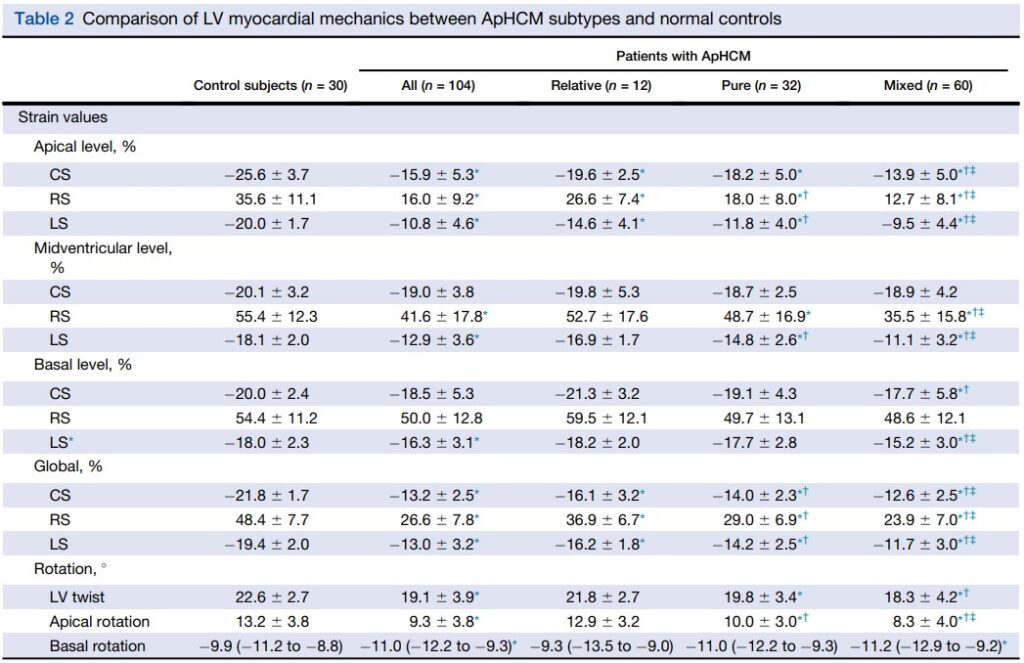
Comparado com o grupo controle, pacientes com CMPH Apical relativa demonstraram manutenção da rotação apical (12.9 ± 3.2 graus x 13.2 ± 3.8 graus, P = 0.997) e do twist (21.8 ± 2.7 graus x 22.6 ± 2.7 graus, P = 0.932), porém com o strain apical significativamente reduzido (strain longitudinal: 14.6 ± 4.1% x 20.0 ± 1.7%, P = 0.001 / strain circunferencial: 19.6 ± 2.5% x 25.6 ± 3.7%, P = 0.002 / strain radial: 26.6 ± 7.4 x 35.6 ± 11.1%, P = 0.026).
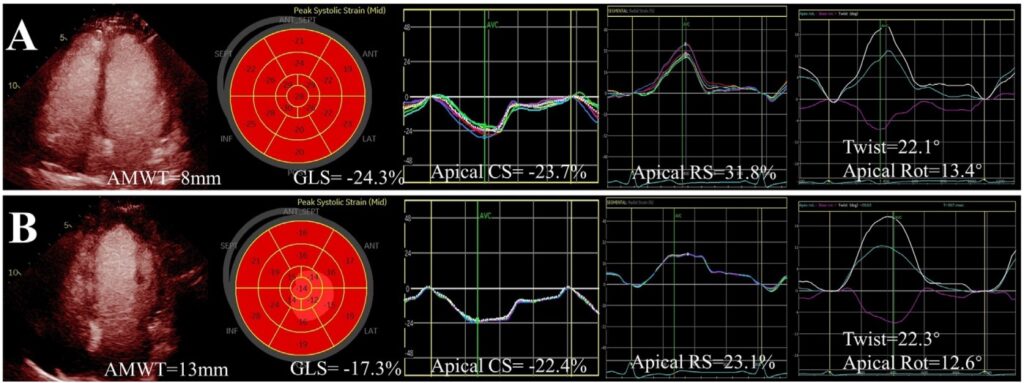
Os valores do strain das regiões médio ventricular e basal, contudo, permaneceram dentro da normalidade.
Com o aumento da hipertrofia apical, pacientes do subtipo puro tiveram uma rotação apical reduzida, com declínio sustentado do strain radial e do strain longitudinal na região apical. Não houve diferença do strain circunferencial em relação aos pacientes do subtipo relativo da CMPH Apical.
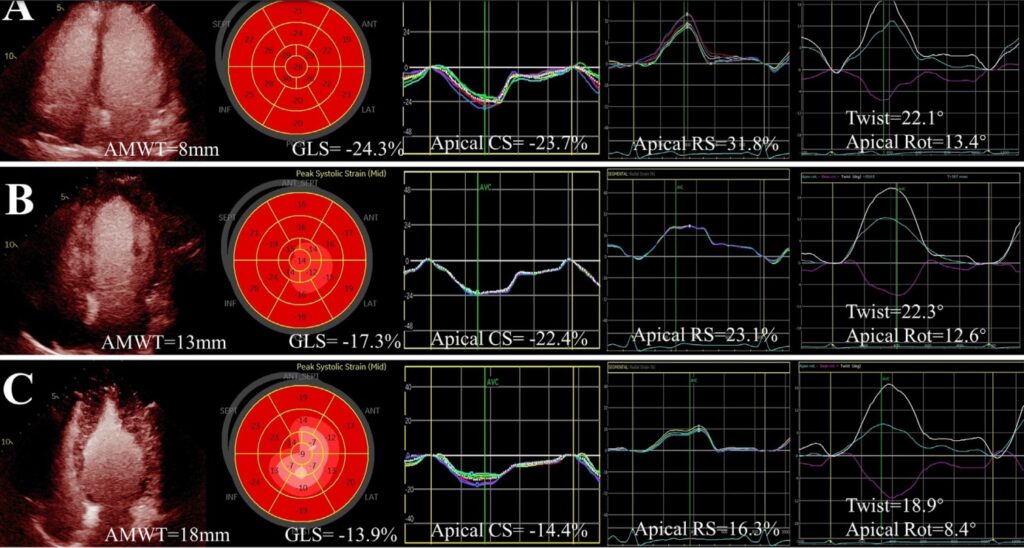
À medida em que a hipertrofia se estende para a região médio ventricular, os pacientes com CMPH Apical mista não apenas mostraram uma redução significativa do strain apical e da rotação, como também apresentaram uma redução do strain longitudinal (11.1 ± 3.2 % x 14.8 ± 2.6%, P < 0.001) e do strain radial (35.5 ± 15.8% x 48.7 ± 16.9%, P = 0.002) no plano médio ventricular comparados com pacientes com CMPH Apical pura, padrão este não observado no strain circunferencial (18.9 ± 4.2% x 18.7 ± 3.4%, P = 0.271).
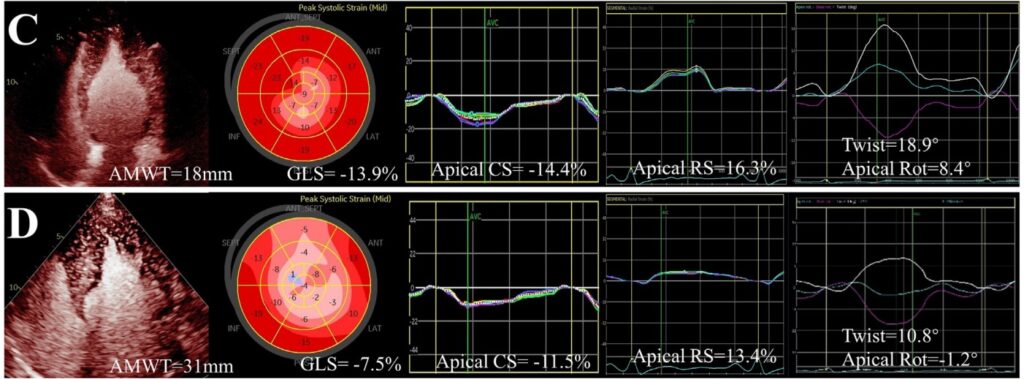
Quanto ao twist, foi observada uma redução significativa nos pacientes com CMPH Apical mista, bem como da rotação apical comparado com pacientes do grupo controle e do subtipo relativo. Embora não se tenha observado diferença significativa do twist do VE (18.3 ± 4.2 graus x 19.8 ± 3.4 graus, P = 0.271) entre os subtipos puro e misto, houve uma redução significativa da rotação apical (8.3 ± 4.0 graus x 10.0 ± 3.0 graus, P = 0.048) quando comparados com os pacientes do subtipo puro.
Pacientes com maior relação de obliteração apical do VE (≥ 0.5) pertenciam predominantemente ao subtipo misto (87%). Esses pacientes tinham uma região apical mais hipertrófica, maiores volumes indexados do AE e uma prevalência elevada de aneurisma apical comparados com aqueles com a relação de obliteração apical < 0.5.
Da mesma forma, uma redução mais significativa do strain e da rotação no ápex foi observada nos pacientes com obliteração severa. Os valores absolutos do strain longitudinal e do strain radial no plano médio ventricular também apresentou diminuição significativa naqueles com relação de obliteração apical ≥ 0.5.
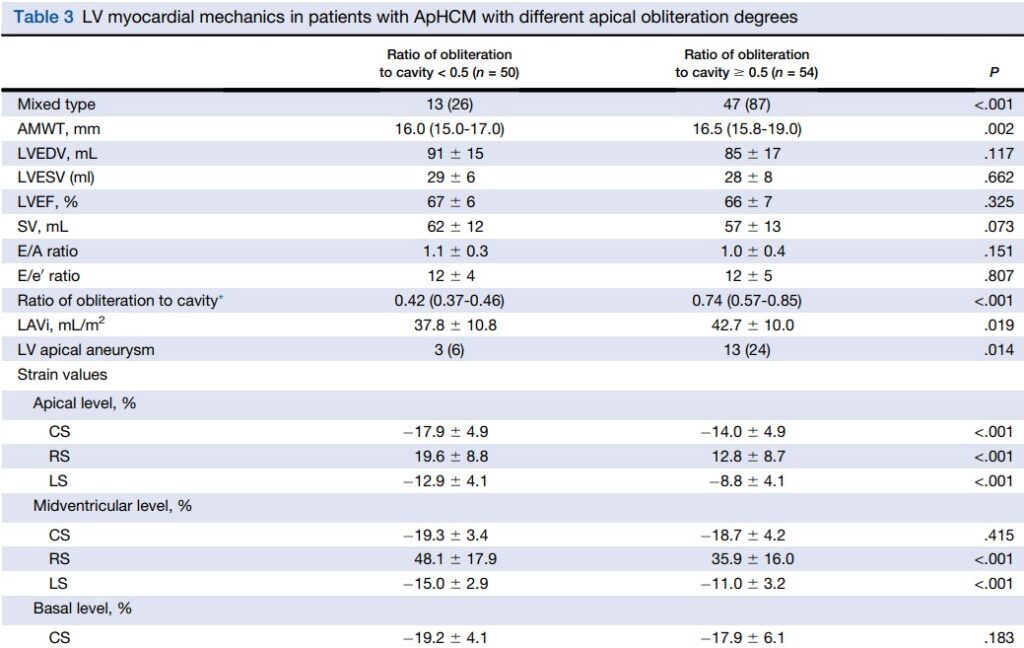
Nos segmentos basais, apenas o strain longitudinal apresentou redução. Tudo isso resultou em um strain longitudinal global e um twist reduzidos.
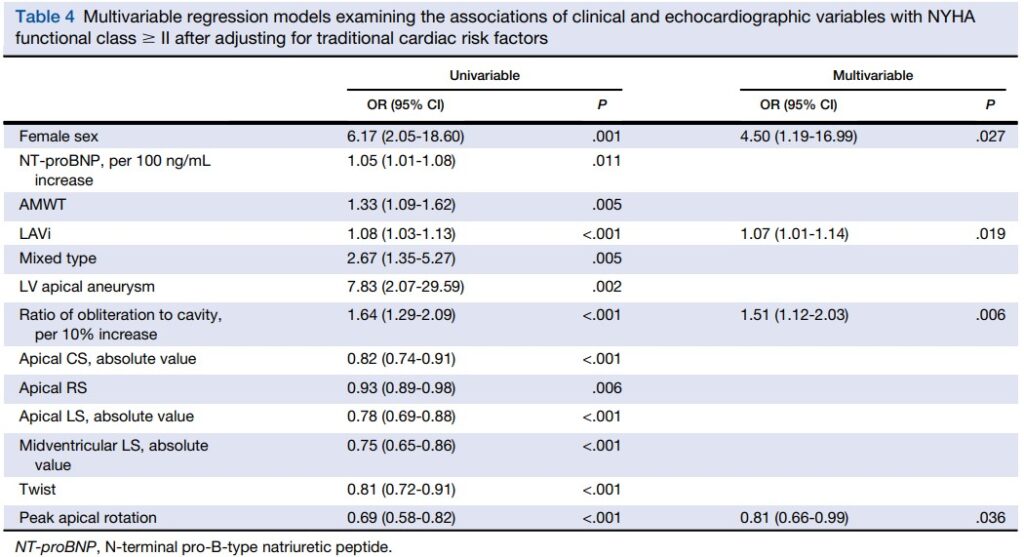
Quando aos parâmetros clínicos, entre os pacientes com CMPH Apical, 44 apresentaram classe funcional (NYHA) ≥ II, sendo esses majoritariamente (75%) do subtipo misto. Além disso, esses pacientes tinham maior espessura diastólica máxima da região apical (16.0 mm x 17.0 mm, P = 0.003), maior relação de obliteração apical (0.45 x 0.73, P <0.001), maiores volumes indexados do AE (44.6 ± 10.3 ml/m² x 37.2 ± 9.8 ml/m², P < 0.001) e maior prevalência de aneurisma apical (30% x 5%, P <0.001).
Comparados com os pacientes portadores de CMPH Apical assintomáticos, os que estavam em classe funcional ≥ II mostraram redução mais significativa dos strain e rotação apicais e globais. O valor absoluto do strain longitudinal médio ventricular também foi menor.
Sexo feminino (OR 4.50, IC 95%: 1.19-16.99, P = 0.27), volume indexado do AE (OR 1.07, IC 95%: 1.01-1.14, P = 0.19), relação de obliteração (OR 1.51, IC 95%: 1.12-2.03, P = 0.006) e rotação apical (OR 0.81, IC 95%: 0.66-0.99, P = 0.036) foram independentemente associados à classe funcional ≥ II em pacientes com CMPH Apical.
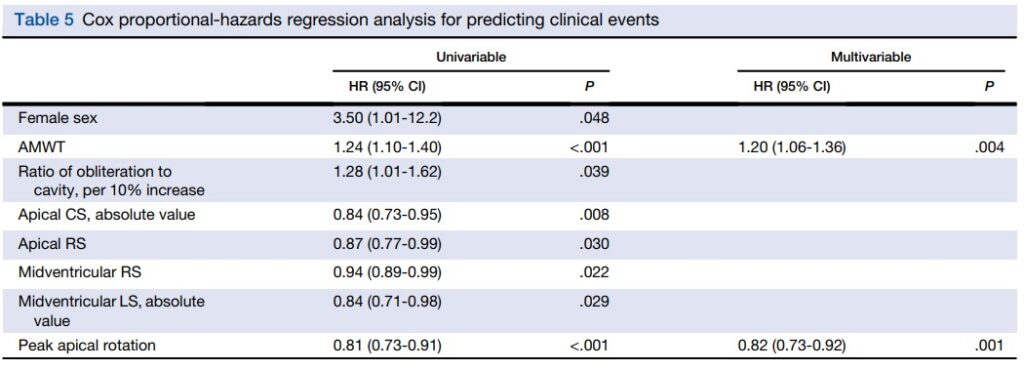
Durante o seguimento médio de 26 meses, 10 pacientes apresentaram eventos clínicos (01 = fibrilação atrial, 03 = internação por insuficiência cardíaca, 06 = submetidos à miomectomia por sintomas refratários). 09 participantes, por sua vez, perderam seguimento e não houve morte documentada.
Pacientes que apresentaram eventos clínicos tiveram strain circunferencial apical (12.0 ± 4.7% x 16.3 ± 5.1%, P = 0.13), rotação apical (5.2 ± 4.8 graus x 9.8 ± 3.5 graus, P < 0.001) menores em comparação com aqueles sem eventos clínicos.
Todos esses pacientes estavam entre aqueles com classe funcional ≥ II e tinham o subtipo misto. Contudo, classe funcional ≥ II ( P = 0.078) e subtipo misto (P = 0.127) não foram preditores de eventos clínicos na análise univariada Cox.
Já na análise multivariada, a espessura diastólica máxima da região apical do VE (HR: 1.20; IC 95% 1.06-1.36, P = 0.004) e rotação apical (HR 0.82; IC 95%: 0.73-0.92, P = 0.001) foram fatores independentemente associados a eventos clínicos.
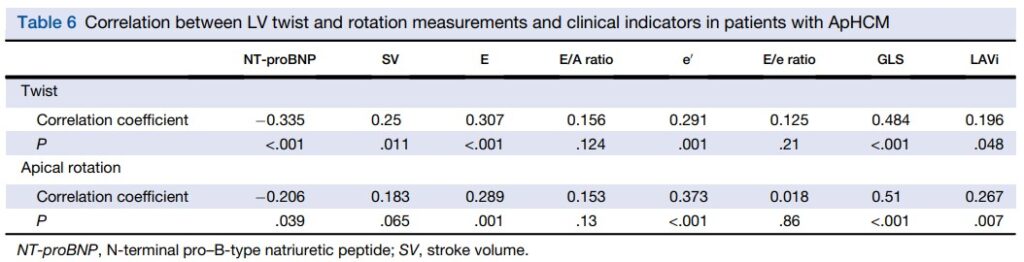
Nos pacientes com CMPH Apical houve uma correlação negativa entre o twist do VE e NT pro-BNP (r = -0.003, P < 0.001) e uma correlação fraca com o volume ejetado do VE (r = 0.25, P = 0.011). Ainda, o twist demonstrou uma correlação moderada com o strain global longitudinal (r = 0.484, P < 0.001) e uma correlação fraca com o volume indexado do AE (r = 0.267, P = 0.007).
Os autores concluem, enfim, que mesmo em estágio inicial da CMPH Apical, o strain apical já se mostrou reduzido, mesmo com a preservação da rotação apical. Pacientes com obliteração apical severa, classe funcional ≥ II e aqueles que apresentaram eventos clínicos demonstraram uma redução significativa da função apical.
À medida em que a doença progride, há uma diminuição da rotação apical e esta se associou, de forma independente, tanto com classe funcional ≥ II quanto com eventos clínicos. Essas alterações da mecânica cardíaca, portanto, não só servem como um parâmetro de gravidade da doença, mas também como variáveis com capacidade de adicionar indicadores prognósticos, sendo útil par a tomada de decisões clínicas.

Graduado em medicina pela Universidade Potiguar (UnP). Possui residência em Clínica Médica pelo Hospital Universitário Onofre Lopes – HUOL (UFRN) e em Cardiologia pelo Procape – UPE. Porta o título de especialista em Cardiologia pela Sociedade Brasileira de Cardiologia (SBC) e é pós-graduado em Ecocardiografia, pela ECOPE.