Apesar dos avanços nos métodos de análise, ainda há grandes lacunas e dúvidas no estudo do processo de adaptação do VD em várias condições patológicas e fisiológicas.
Tromboembolismo pulmonar agudo.
Há controvérsias sobre o papel da região apical do VD na sobrecarga pressórica aguda que ocorre no tromboembolismo pulmonar, principalmente quando há o sinal de McConnell, presente em quase metade dos pacientes. Como ele ocorre também em grande número de casos de infarto do VD, é considerado um sinal pouco específico [14] (Figura 17).
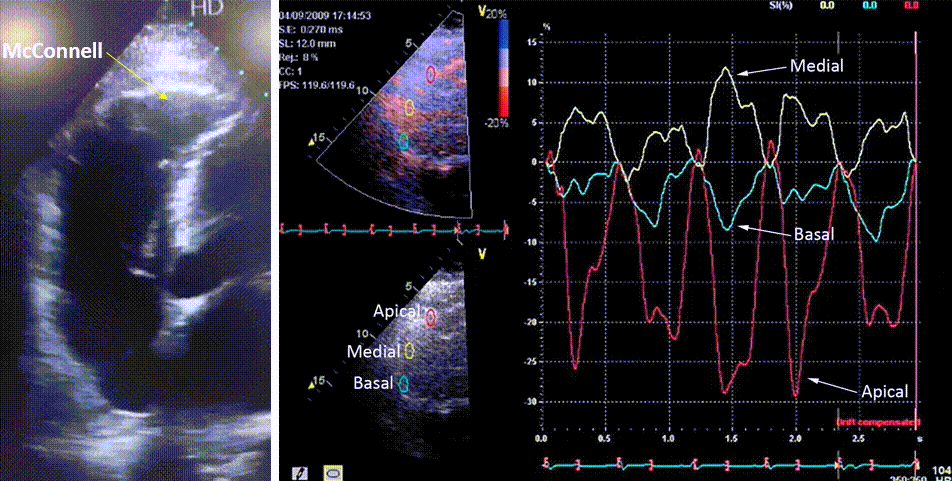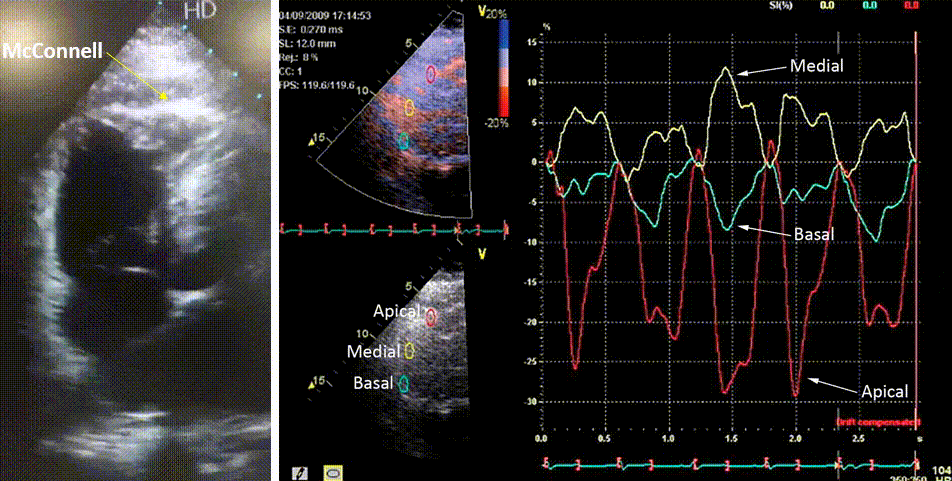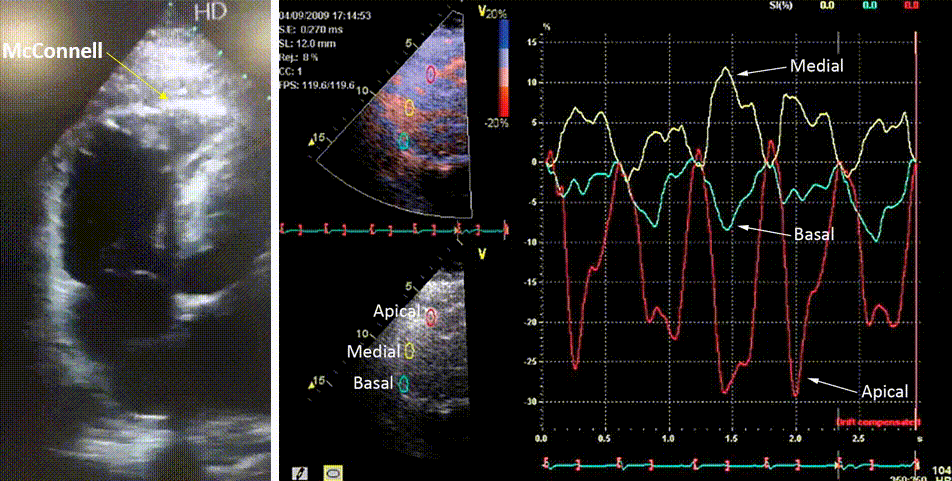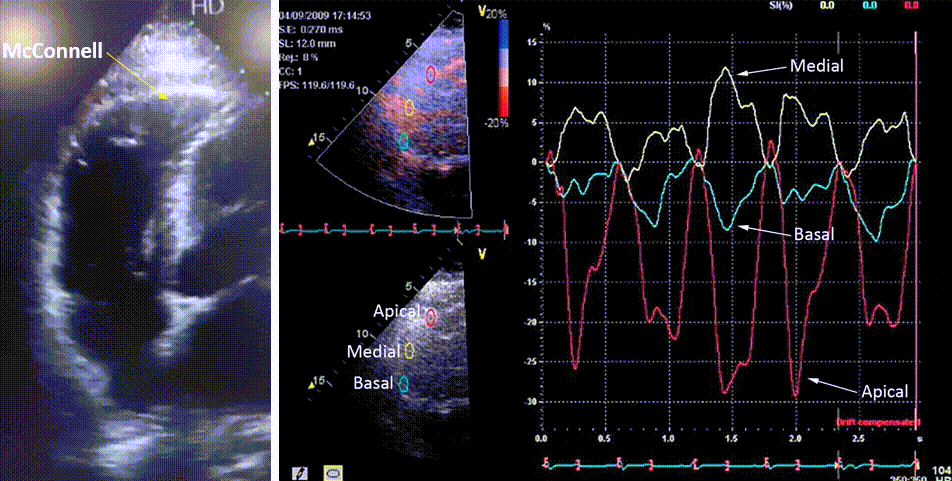
Para alguns autores [15] há manutenção da função apical do VD, considerando o sinal de McConnell um fenômeno ativo, como visto na figura acima, havendo recuperação da função do VD, primeiro basal e finalmente medial, após o início do tratamento com trombolíticos (Tabela abaixo).
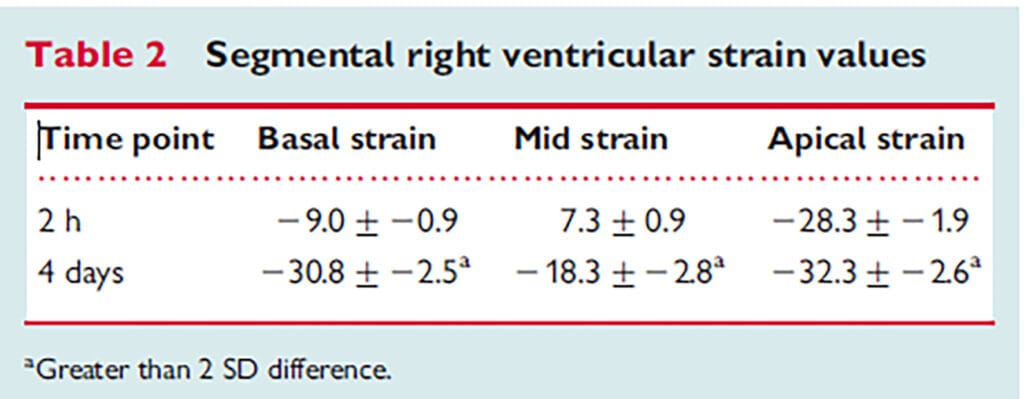
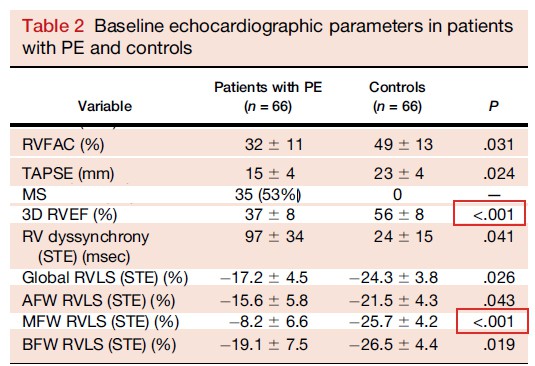
Para outros autores o sinal de McConnell é um fenómeno passivo [16], provocado pela tração da região apical do VE, que aumenta sua contratilidade para manter o débito cardíaco, com valores de strain longitudinal do VD diminuídos, principalmente nos segmentos médios, como podemos ver na Tabela abaixo, onde se observa que os únicos parâmetros significativamente diminuídos entre os pacientes com tromboembolismo pulmonar e os controles sadios foram a fração de ejeção por ecocardiograma 3D e o strain longitudinal da parede lateral média do VD [17].
De qualquer forma, a relativa manutenção da deformação apical do VD na sobrecarga pressórica aguda nos faz pensar em um possível mecanismo intrínseco de torção apical que deve ser melhor investigado.
Coração direito no atleta.
Como vimos anteriormente, o VD apresenta grande estresse sistólico parietal quando submetido ao aumento do débito cardíaco, como ocorre durante o exercício. O VD, estruturalmente mais adaptado a baixas pressões, apresenta menor extração de VO2 e menor fluxo coronário do que o VE. Isto, associado ao aumento agudo da pressão pulmonar, provoca maior dilatação e hipertrofia, principalmente em atletas de resistência, que praticam exercícios com predomínio aeróbico. O aumento do estresse parietal sistólico (mais de 125% com relação ao basal) é compensado, em atletas sadios, pela reserva contrátil do VD. Em exercício prolongado e intenso, sem o devido tempo de recuperação, pode provocar um fenótipo de disfunção ventricular direita arritmogênica.
Algumas das causas da difícil adaptação do VD é a baixa resistência do leito pulmonar, produto dos seguintes fatores: presença de grande quantidade de arteríolas com anastomoses em paralelo, paredes finas com baixo tônus basal, maior complacência vascular (a >complacência corresponde <resistência), “expansão” dos vasos com o fluxo pulsátil diminuindo a resistência com aumento brusco da pressão e a dependência da pós carga da pressão venosa (Figura 18).

Assim, o exercício prolongado estimula a expressão genética, provocando alterações moleculares que resultam em adaptação celular por estímulo da síntese proteica, levando à hipertrofia das paredes, adaptando o ventrículo ao aumento do débito cardíaco.
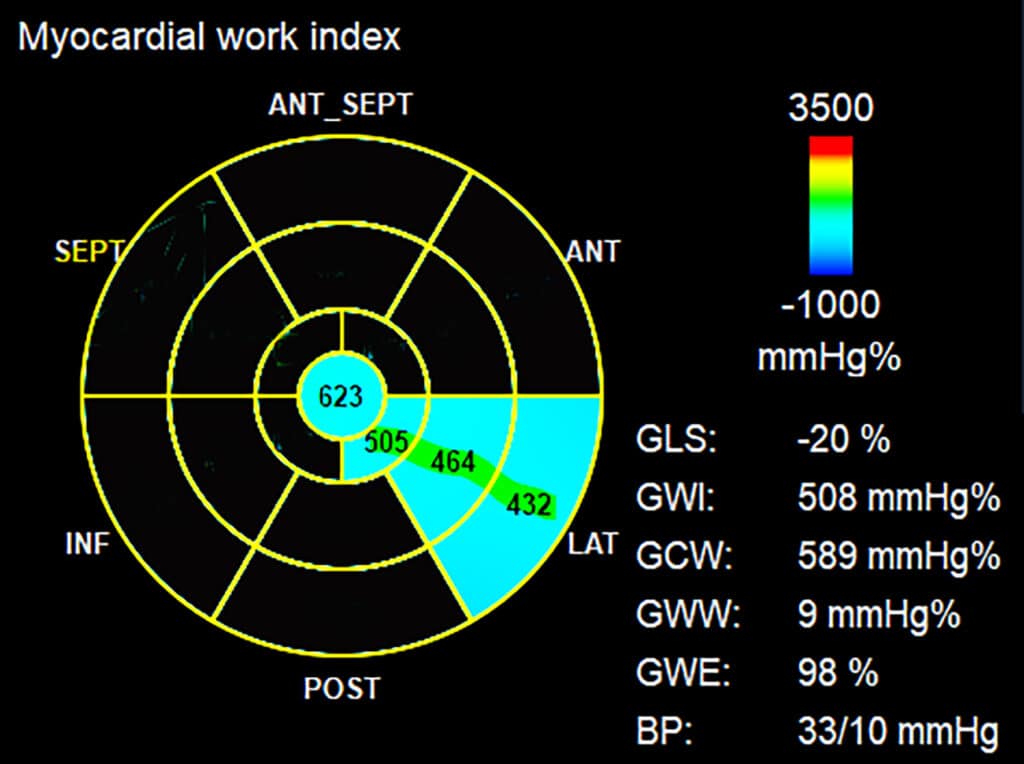
E outra vez a região apical do VD responde com maior deformação, deixando a dúvida de se é um fenômeno passivo (arrastamento provocado pela ponta do VE hipercinético) ou ativo (algum grau de rotação apical no VD). Estudos preliminares com trabalho miocárdico, realizados pelo Dr. João Giffoni da Silveira Neto, nos mostram que o trabalho da parede lateral apical do VD é maior que no resto da parede (Figura 19), deixando no ar essa questão que deve ser esclarecida para o melhor conhecimento desta câmara, frequentemente denominada “esquecida”, pero no tanto…
Referências.
14. Mazur ES, Mazur VV, Rabinovich MR, Myasnikov KS. Right ventricular longitudinal strain in acute pulmonary embolism and right ventricular myocardial infarction in patients with McConnell’s sign. Kardiologia 2020; 60:20-27.
15. Lo A, Stewart P, Younger JF, Atherton J, Prasad SB. Usefulness of right ventricular myocardial strain in assessment of response to thrombolytic therapy in acute pulmonary embolism. Eur J Echocardiogr 2010; 11:892-895.
16. Platz E, Hassanein AH, Shah A, Goldhaber SZ, Solomon SD. Regional right ventricular strain in patients with acute pulmonary embolism. Echocardiography 2012; 29:464-470.
17. Vitarelli A, Barilla F, Capotosto L, D’Angeli I, Truscelli G, De Maio M, Ashurov R. Right ventricular function in acute pulmonary embolism: A combination assessment by three-dimensional and speckle-tracking echocardiography. J Am Soc Echocardiogr 2014; 27:329-338.

É doutor em medicina, especialista em Cardiologia (SBC) e especialista em Ecocardiografia.
Curriculum completo disponível na Plataforma Lattes
(http://lattes.cnpq.br/4922446519082204)