Como se adapta do VD às diferentes condições de carga?
Sobrecarga pressórica.
Quando submetido à sobrecarga pressórica, como hipertensão pulmonar ou TEP, o VD apresenta dilatação da cavidade seguida de diminuição da função sistólica longitudinal, o que se manifesta por diminuição do TAPSE, onda s’ do anel tricúspide, FAC e strain longitudinal global e da parede lateral, tanto maior quando mais importante a sobrecarga. Gradativamente, ocorre hipertrofia das paredes, com remodelamento, principalmente das camadas de fibras circulares da banda basal, que ocupa a região subepicárdica da parede (Figura 9).
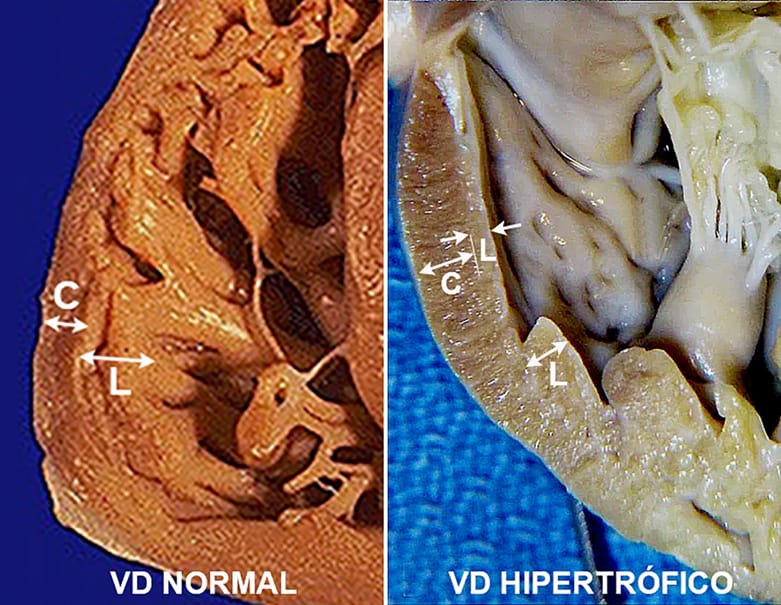
Isto se traduz por um aumento significativo do strain radial que, em condições normais, na parede do VD apresenta valores médios de 14,6±3,2% aumentando para 25,9±15% em valores globais. Este aumento traduz a adaptação do VD à sobrecarga de pressão, de forma a compensar, em parte, o aumento do estresse sistólico parietal provocado pelo aumento de pressão intracavitária e pela dilatação da cavidade (Figura 10).
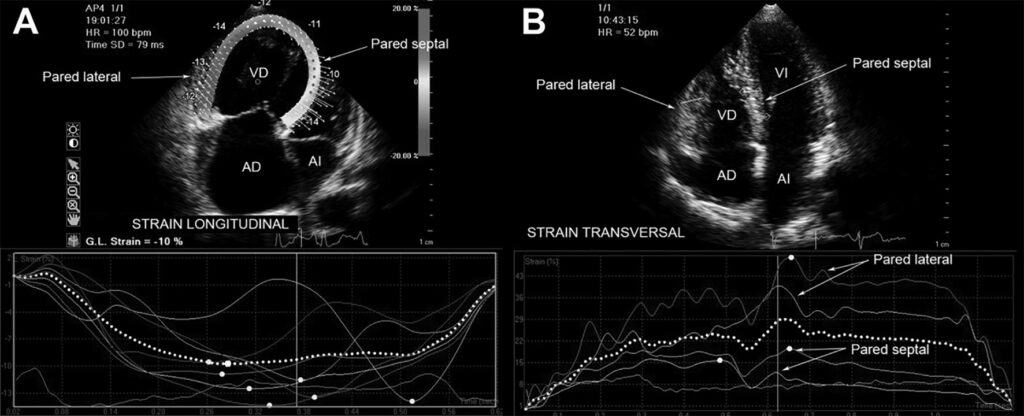
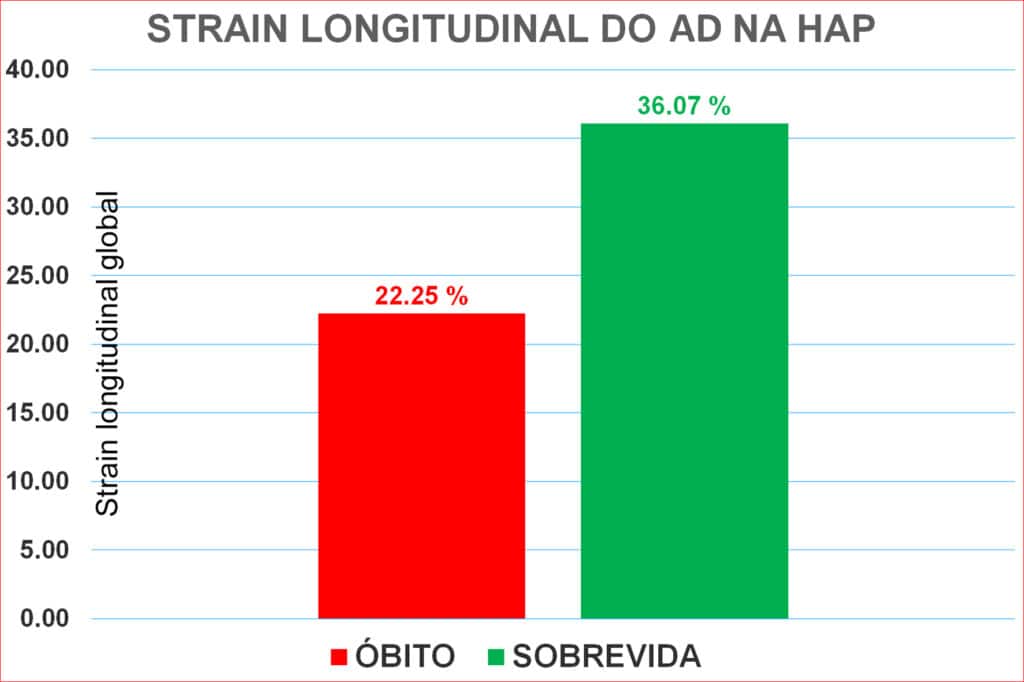
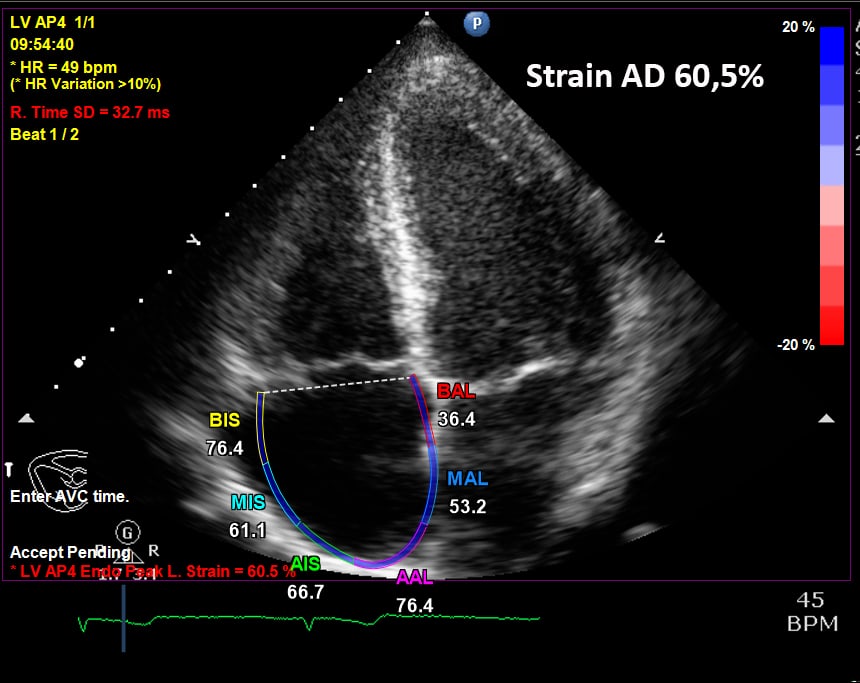
O strain longitudinal do AD é importante para verificar a compensação do VD. Pacientes com boa resposta clínica ao tratamento com vasodilatadores da circulação pulmonar apresentam deformação longitudinal do AD maior que os pacientes com descompensação, o que veio sem corroborado no estudo comparativo entre os pacientes sobreviventes e os que evoluíram para óbito (Figura 11).
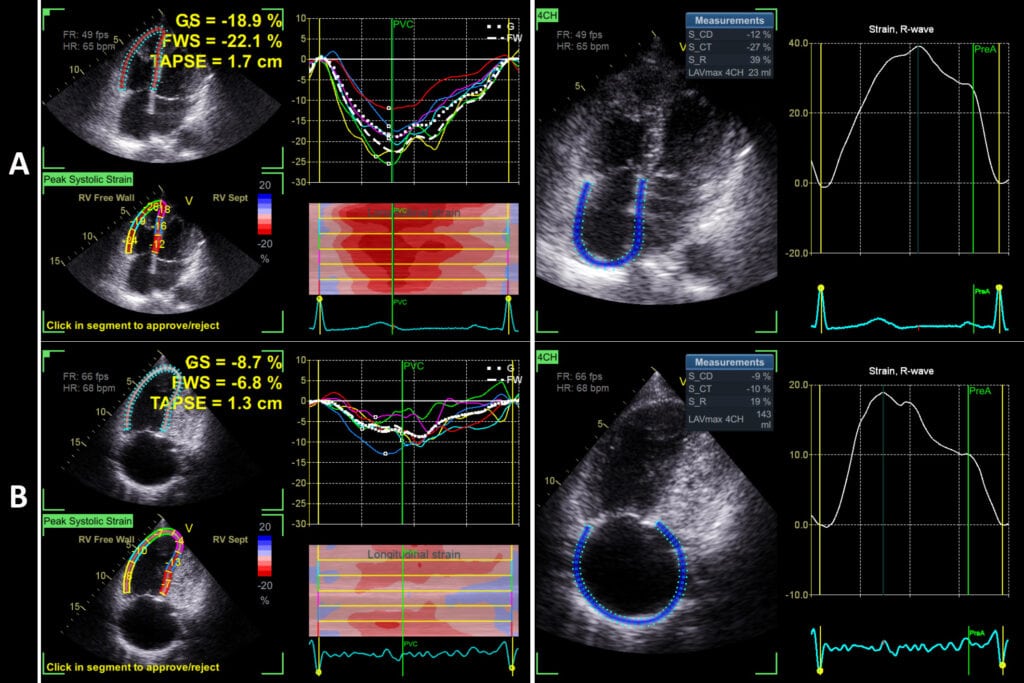
Na Figura 12, exemplo da relação entre o strain longitudinal do VD e AD em paciente com hipertensão pulmonar na forma compensada e descompensada.
Sobrecarga volumétrica.
Na sobrecarga volumétrica sem aumento significativo da pressão pulmonar (CIA com shunt E-D) observamos manutenção dos parâmetros de função sistólica do VD, inclusive do strain longitudinal e da função do AD. O strain transversal (radial) evidencia aumento, sugerindo remodelamento do VD com aumento de espessura da camada de fibras circulares subepicárdicas, provavelmente para compensar o aumento do estresse sistólico parietal devido à dilatação da cavidade
Ao exercício.
A resposta adaptativa do VD ao exercício prolongado e intenso é precoce, com dilatação das cavidades ventricular, atrial e VCI. Os parâmetros de função sistólica convencionais são normais (TAPSE, onda s’ do anel tricúspide e FAC). O strain longitudinal do VD é normal, com predomínio da deformação apical e o strain do AD encontra-se aumentado (Figuras 13 e 14).
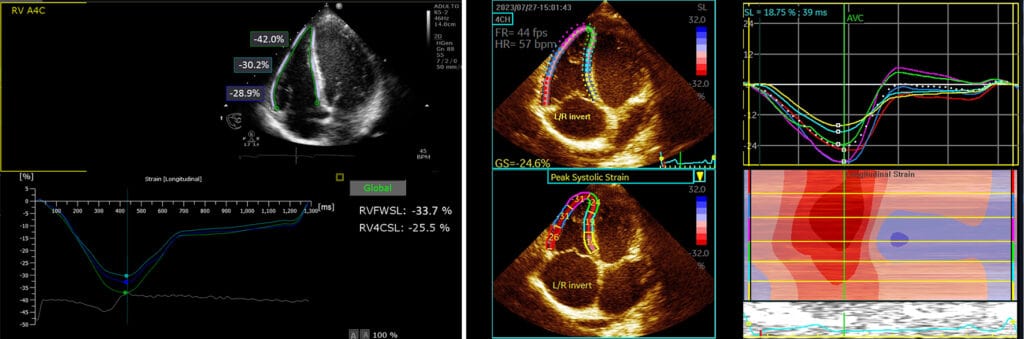
Exercício de grande intensidade provoca aumento do débito cardíaco 3 a 5 vezes acima do normal e, devido ao VD estar conectado à circulação pulmonar, que apresenta baixa resistência e elevada complacência, há grande aumento da pressão pulmonar, com elevação do estresse parietal sistólico do VD até 125 vezes maior que o normal (no VE o estresse aumenta apenas 14%). Assim, teremos um aumento linear entre a pressão média pulmonar e o débito cardíaco, ocorrendo tanto em atletas como em indivíduos sedentários [10]. Para cada litro de débito há um aumento de 1,5 mmHg de pressão média na artéria pulmonar. Para um débito extremo de 30 L/min a pressão média pulmonar pode exceder os 50 mmHg (Figura 15).
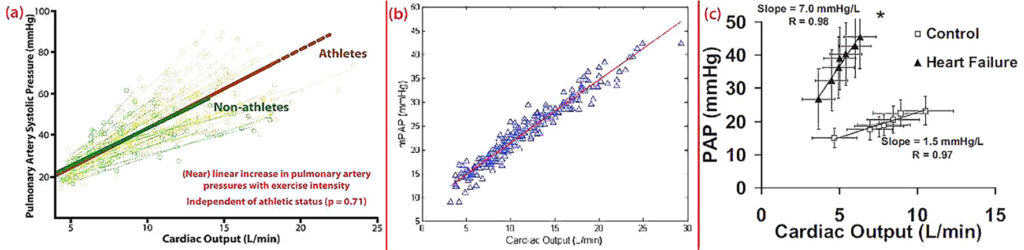
Estudos com acoplamento ventriculoarterial e strain rate longitudinal do VD demonstraram que o VD tem reserva contrátil suficiente para sustentar o aumento agudo da pós-carga durante o exercício [11].
Como o VD apresenta menor massa e menor reserva contrátil, tem menor capacidade de adaptação ao aumento agudo da carga, temos que o aumento da pressão pulmonar induzida por exercício diminui o volume de ejeção, limitando a capacidade de adaptação do VD. Há aumento do volume do VD (mais de 16%) e diminuição do volume do VE (menos de 8%), quando avaliado com eco 3D. Estudos [12, 13] sugerem que o exercício prolongado pode provocar “fadiga” do VD, induzindo diminuição da FE e aumento da troponina cardíaca em maratonistas e atletas de triátlon de ultra resistência. A recuperação da função do VD após exercício intenso e prolongado depende do tempo de recuperação (Figura 16).
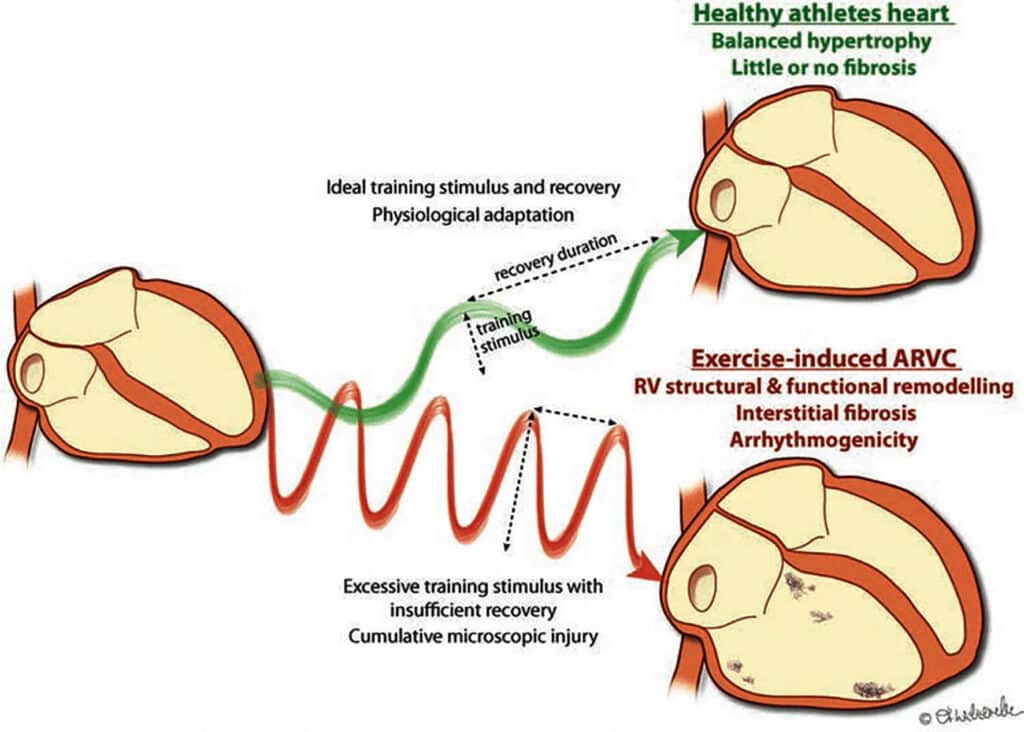
Experimentalmente, observou-se aumento da fibrose induzindo arritmias. Estudos com RMC e gadolínio mostraram áreas de realce tardio em 13 a 50% de atletas de resistência, com remodelamento fibrótico e probabilidade de ocorrência de arritmias.
No próximo Blog veremos os desafios que temos pela frente na análise da adaptação do VD.
Referências.
10. Lewis GD, Murphy RM, Shah RV, Pappagianopoulos PP, Malhotra R, Bloch KD, et al. Pulmonary vascular response patterns during exercise in left ventricular systolic dysfunction predict exercise capacity and outcomes. Circ Heart Fail 2011; 4:276-285.
11. La Gerche A, Heidbuchel H, Burns AT, Mooney DJ, Taylor AJ, Pfluger HB, et al. Disproportionate exercise load remodeling of the athlete’s right ventricle. Med Sci Sports Exerc 2011; 43:974-981.
12. Trivax JE, Franklin BA, Goldstein JA, Chinnaiyan KM, Gallagher MJ, DeJong AT, et al. Acute cardiac effects of marathon running. J Appl Physiol 2010; 108:1148-1153.
13. La Gerche A, Roberts T, Claessen G. The response of the pulmonary circulation and right ventricle to exercise: Exercise-induced right ventricular dysfunction and structural remodeling in endurance athletes (2013 Grover Conference Series). Pulm Circ 2014; 4:407-416.

É doutor em medicina, especialista em Cardiologia (SBC) e especialista em Ecocardiografia.
Curriculum completo disponível na Plataforma Lattes
(http://lattes.cnpq.br/4922446519082204)