Tópicos
Parâmetros para avaliação da função e remodelamento do VD
Como vimos nas partes iniciais desta sequência de artigos, os parâmetros de avaliação do VD compreendem a análise da função (FAC ou variação de áreas, TAPSE ou excursão sistólica do anel tricúspide, velocidade s’ com Doppler tissular do anel tricúspide, fração de ejeção 3D e strain longitudinal global e da parede lateral), estimativas das pressões (gradiente de refluxo tricúspide, tempo de aceleração pulmonar, resistência vascular pulmonar, parâmetros que avaliam o tipo de remodelamento, excêntrico ou concêntrico e parâmetros que avaliam a adaptação da câmara (acoplamento ventrículo-arterial). O conjunto destas aferições permite conhecer o estado funcional do VD e suas implicações prognósticas.
Acoplamento ventrículo-arterial
Considerado o parâmetro mais importante para avaliar a função e, principalmente, a adaptação do VD às condições de sobrecarga pressórica em todos os tipos de hipertensão pulmonar (HP), seja esta pré-capilar, pós-capilar ou combinada, consiste em estabelecer a relação entre a elastância ventricular de final de sístole (Ees) e a elastância arterial (ea), cuja relação entre 1,5 e 2 corresponde ao melhor débito ventricular direito com mínimo custo energético. Um desacoplamento VD-AP progressivo está associado com manutenção das dimensões do VD e diminuição da relação Ees/Ea a valores em torno de 0,8 indicando que esta relação monitora a transição entre a função compensada e descompensada do VD na HP.
Esta aferição, normalmente é realizada durante o cateterismo cardíaco pela relação entre a pressão sistólica final e o volume sistólico final (Ees) e entre a pressão sistólica final e o volume de ejeção (Ea) em uma curva de pressão volume obtida durante vários ciclos cardíacos, com ou sem estimulação inotrópica. Embora o cateterismo cardíaco seja o padrão-ouro para análise do VD, sua indicação deve ser realizada com cuidado, devido a ser um método invasivo não isento de complicações.
Ecocardiografia
Recentemente surgiram várias metodologias de avaliação do acoplamento ventrículo-arterial utilizando a ecocardiografia.
Relação TAPSE/PSAP. Este método, o mais empregado, correlaciona o TAPSE como substituto da contratilidade do VD com a pressão sistólica pulmonar (PSAP) estimada pela velocidade do refluxo tricúspide (Vrt) como substituto da pós-carga. Valores inferiores a 0,36 mm.cm/s correlacionam-se com maior desacoplamento VD-AP indicando desadaptação do VD em pacientes com HP pós-capilar (1). Em pacientes com HP pré-capilar devida a doença pulmonar idiopática e tromboembólica a relação TAPSE/Vrt inferior a 0,31 mm.cm/s correlaciona-se com desacoplamento VD-AP <0,8 estimado pelo estudo hemodinâmico com sensibilidade de 87,5% e especificidade de 75,9%(2). A análise de nossa autoria (3) em pacientes com HP, sobrecarga volumétrica do VD por CIA e indivíduos sadios observamos os seguintes valores de TAPSE, Velocidade de refluxo tricúspide e relação TAPSE/Vrt (Tabela abaixo).
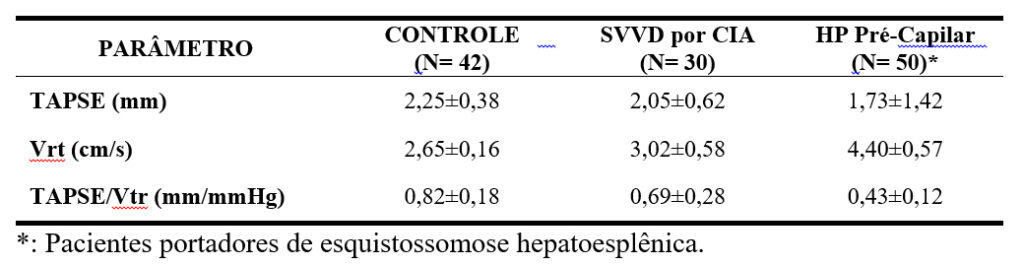
Por outro lado, o TAPSE isoladamente, é importante fator para determinar a possibilidade de HP (3) (Tabela abaixo).

Strain da parede lateral do VD/PSAP. Um novo índice para identificar descompensação do VD em pacientes com bloqueio de ramo esquerdo e HP consiste no Strain Longitudinal Global do VD indexado à pressão sistólica do VD calculada pelo refluxo tricúspide. Valores inferiores a 0,35 indicam desacoplamento VD-AP com sensibilidade de 80% e especificidade de 77% em pacientes submetidos a terapia de ressincronização portadores de HP (5). Novamente, em pacientes do estudo da nossa autoria achados os seguintes valores (Tabela abaixo).
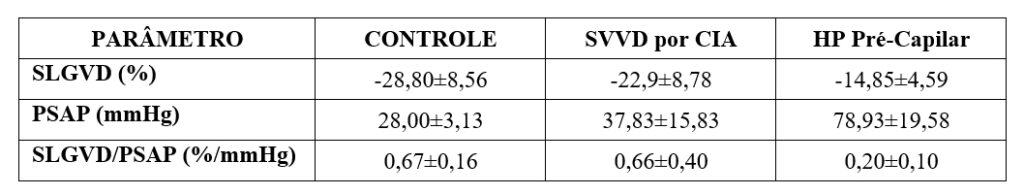
Acreditamos que este índice possa ser útil nas diversas formas de HP, seja pré-capilar ou pós-capilar.
O Strain Longitudinal Global do VD e da Parede Lateral do VD se altera em pacientes com descompensação dessa cavidade, sendo útil na estratificação de pacientes com HP. Diminuição < -13,7% é preditor de menor sobrevida (6).
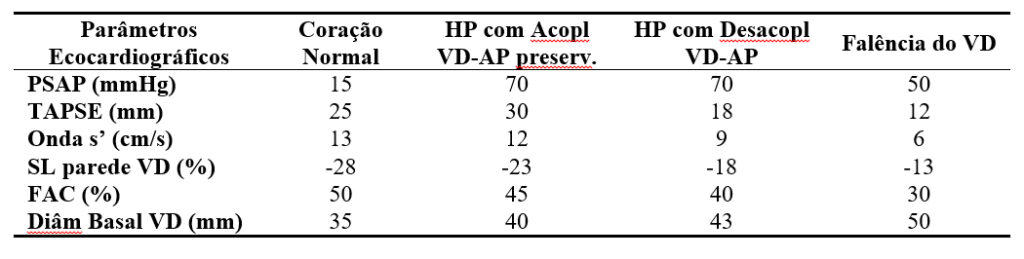
Na Tabela abaixo encontra-se um resumo das alterações ecocardiográficas encontradas na HP com relação à função do VD (7).
Implicações prognósticas e tratamento
A correta identificação do tipo e repercussão da HP é de fundamental importância para o tratamento, visto a alta mortalidade desta patologia, estimada em cerca de 25% em 3 anos (8).
Grupo 1 de HP (idiopática). Embora o valor atual da PMAP tenha sido estabelecido em >20 mmHg para o diagnóstico de HP (9), inicia-se o tratamento quando a PMAP for maior que 25 mmHg. Pacientes com PMAP entre 21 e 24 mmHg devem ser cuidadosamente acompanhados. Quando a HP é decorrente de doença sistêmica, o tratamento específico é fundamental. Resumimos abaixo os principais itens para o tratamento da HP.

Grupo 2 de HP (doenças do coração esquerdo). O aumento passivo da pressão veno-capilar pulmonar determina a vasoconstrição arteriolar com elevação da pressão pulmonar havendo, também, ativação de mecanismos neuro-hormonais que desencadeiam o remodelamento vascular, podendo acrescentar um componente pré-capilar. O tratamento deve ser focado na doença de origem. O uso de prostaglandinas, utilizado como coadjuvante em casos mais graves com HP combinada, apresentou aumento da mortalidade, pelo que seu uso foi interrompido (10). Os resultados da utilização dos antagonistas dos receptores da endotelina (11) (Bosentana) e da fosfodiesterase-5 (Sildenafila) não evidenciaram nenhuma alteração, ou mesmo piora clínica dos pacientes (12).
Grupo 3 de HP (doença pulmonar e/ou hipóxia). É a segunda causa mais frequente de HP e compreende pacientes com DPOC, doença pulmonar intersticial, fibrose pulmonar combinada e enfisema. Apenas uma minoria destes pacientes apresenta PMAP >35 mmHg, não havendo nenhuma evidência de melhora clínica com a utilização da medicação específica (13).
Grupo 4 de HP (obstruções da artéria pulmonar e tromboembolismo pulmonar crônico). Única forma potencialmente curável de HP, seu tratamento consiste na trombectomia cirúrgica ou percutânea e na anticoagulação plena. O Riociguate, agindo de forma semelhante aos inibidores da fosfodiesterae-5, apresenta resultados favoráveis nesta forma de HP (14).
Grupo 5 de HP (por mecanismos multifatoriais). O tratamento é heterogêneo, em geral, voltado para a doença de base. Pacientes com HP por esquistossomose hepatoesplênica beneficiam-se com os antagonistas da endotelina (Bosentana) e com os inibidores da fosfodiesterase-5 (Sildenafila) (15).
Desta forma concluímos nossa análise do ventrículo direito e suas alterações patológicas.
Referências bibliográficas
1- Guazzi M, Naeije R, Arena R, et al. Echocardiography of right ventriculoarterial coupling combined with cardiopulmonary exercise testing to predict outcome in heart failure. Chest 2015; 148: 226-234.
2- Tello K, Wan J, Dalmer A, et al. Validation of the tricuspid annular plane systolic excursion/systolic pulmonary artery pressure ratio for the assessment of right ventricular-arterial coupling in severe pulmonary hypertension. Circ Cardiovasc Imaging 2019; 12: e009047.
3- Verhoeff K and Mitchell JR. Cardiopulmonary physiology: why the heart and lungs are inextricably linked. Adv Physiol Educ 2017; 41: 348-353.
4- Castillo JM, Albuquerque ES, Silveira CAM et al. Right ventricle: Echocardiographic evaluation of pressure and volume overload. Rev Argent Cardiol 2016; 84:581-587.
5- Deaconu S, Deaconu A, Scarlatescu A, et al. Ratio between right ventricular longitudinal strain and pulmonary arterial systolic pressure: Novel prognostic parameter in patients undegoing cardiac resynchronization therapy. J Clin Med 2021; 10:2442.
6- Mukherjee M, Mercurio V, Tedford RJ, et al. Right ventricular longitudinal strain is diminished in systemic sclerosis compared with idiopathic pulmonary arterial hypertension. Eur Respir J 2017; 50: 1701436.
7- Fine NM, Chen L, Bastiansen PM, et al. Outcome prediction by quantitative right ventricular function assessment in 575 subjects evaluated for pulmonary hypertension. Circ Cardiovasc Imaging 2013; 6: 711-721.
8- McGoon MD, Benza RL, Escribano-Subias P, et al. Pulmonary arterial hypertension: epidemiology and registries. J Am Coll Cardiol. 2013;62(25 Suppl):D51-9.
9- Simonneau G, Montani D, Celermajer DS, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension. Eur Respir J. 2019;53(1).
10- Califf RM, Adams KF, McKenna WJ, et al. A randomized controlled trial of epoprostenol therapy for severe congestive heart failure: The Flolan International Randomized Survival Trial (FIRST). Am Heart J. 1997;134(1):44-54.
11- Hsu S, Tedford RJ. Will we be singing a different tune on combined post- and pre-capillary pulmonary hypertension? Eur Respir J. 2018;51(2).
12- Bermejo J, Yotti R, Garcia-Orta R, et al. Sildenafil for improving outcomes in patients with corrected valvular heart disease and persistent pulmonary hypertension: a multicenter, double-blind, randomized clinical trial. Eur Heart J 2018;39(15):1255-64.
13- Calderaro D, Alves Jr JL, Fernandes CJCS, et al. Hipertensão pulmonar na prática do cardiologista. Arq Bras Cardiol 2019; 113(3):419-428.
14- Stasch JP, Evgenov OV. Soluble guanylate cyclase stimulators in pulmonar hypertension. Handb Exp Pharmacol. 2013;218:279-313.
15- Graham BB, Bandeira AP, Morrell NW, et al. Schistosomiasis-associated pulmonar hypertension: pulmonar vascular disease: the global perspective. Chest 2010; 137(6):20S-29S.

É doutor em medicina, especialista em Cardiologia (SBC) e especialista em Ecocardiografia.
Curriculum completo disponível na Plataforma Lattes
(http://lattes.cnpq.br/4922446519082204)
FANTÁSTICO
muito bom essa aula parabens deveria manter essa correlacao em todos pacientes com Hap.vou adotar essa correlacao e liberar nnos laudos