Caracterizada pela deposição de tecido fibrótico no endomiocárdio, que resulta em uma fisiologia restritiva, a endomiocardiofibrose continua sendo uma doença misteriosa e desafiadora.
De fisiopatologia ainda não totalmente definida, fatores dietéticos, ambientais e infecciosos estão descritos como determinantes para o surgimento desta doença em indivíduos susceptíveis. Aqui no blog, já falamos especificamente sobre este tema:
A endomiocardiofibrose possui uma fase inicial em que há processo inflamatório intenso, em forma de pancardite, associado a hipereosinofilia. Este processo leva a um edema miocárdico, com infiltração eosinofílica, vasculite e fibrose subendocárdica das miofibrilas.
Nesta fase, as alterações ecocardiográficas observadas são obliteração biventricular, com um padrão homogêneo de infiltração miocárdica associada a derrame pericárdico. A presença de trombo mural é possível e eventos tromboembólicos podem ser uma complicação frequente.
À medida em que o processo inflamatório regride, há queda dos eosinófilos e inicia-se uma fase de hipertrofia dos cardiomiócitos, levando a isquemia miocárdica e fibrose. Aqui se instala a fase crônica da doença.
Agora é comum observarmos um envolvimento biventricular, posteriormente seguido por acometimento preferencial do ventrículo direito (VD). Há uma obliteração apical, com redução da cavidade ventricular direita e dilatação da via de saída do VD, além de aumento do átrio direito (AD), regurgitação tricúspide por aderência dos componentes valvares ao endocárdio, abertura diastólica da valva pulmonar, caracterizando um padrão restritivo.
O acometimento do ventrículo esquerdo (VE) também pode ocorrer, com redução do diâmetro longitudinal da cavidade, que se torna esférica ou oval, dilatação do átrio esquerdo (AE), presença de regurgitação mitral excêntrica com restrição do folheto posterior.
Temos, portanto, uma condição em que há fibrose e obliteração apical do VD e/ou VE, com propensão à formação de trombo. Porém, é importante lembrarmos de outras importantes causas que podem ter apresentação semelhante e são, desta maneira, importantes diagnósticos diferenciais: (1) cardiomiopatia hipertrófica (CMPH) apical, (2) miocárdio não compactado, (3) tumores intracavitários e (4) trombo apical.

Devemos suspeitar de trombo quando observamos a presença de alterações da contratilidade segmentar (acinesia, discinesia) na região adjacente à lesão trombótica.
A CMPH apical, por sua vez, caracteriza-se por uma hipertrofia assimétrica do ápice do VE. Como sabemos, resulta de mutações de genes sarcoméricos e faz parte do espectro fenotípico da cardiopatia geneticamente determinada mais comum no mundo.
O ecocardiograma mostra uma hipertrofia isolada da região apical do VE, com uma configuração em “Ás de espada” da cavidade ventricular esquerda.
Fazer a diferenciação entre essas condições (sobretudo CMPH apical e endomiocardio fibrose) nem sempre é possível através da ecocardiografia. Neste sentido, a ressonância magnética (RM) cardíaca desempenha papel crucial.
No caso da endomiocardiofibrose, há presença de fibrose subendocárdica com o patognomônico sinal em “V” (realce subendocárdico apical sobre o miocárdio normal) ou sinal do “V duplo” (aparência em 3 camadas consistindo em miocárdio normal, realce subendocárdico e trombo sobreposto).
Vale salientar que a endomiocardio fibrose compartilha algumas características da síndrome de Loeffler e a ressonância consegue distinguir estas duas doenças pelo padrão de distribuição do realce subendocárdico.
Já na CMPH apical, fica evidenciada um aumento da espessura da região apical do VE, com realce tardio heterogêneo apical e subendocárdico.

E quando estas duas condições coexistem no mesmo paciente ?! (Alô, Anjo da guarda! cadê você?)
Homem, 68 anos de idade, encaminhado por alteração eletrocardiográfica evidenciada em exame de rotina realizado dois anos antes.

Tinha antecedente de asma brônquica e hipertensão arterial, porém sem histórico familiar de doenças cardiovasculares. No momento, encontrava-se assintomático e com exames laboratoriais normais, incluindo a contagem de eosinófilos.
Ecocardiograma transtorácico com uso de agentes de contraste mostrou padrão de obliteração apical tanto do VD quanto do VE, com diâmetros das cavidades ventriculares normais, assim como função sistólica preservada e sem evidência de trombo.
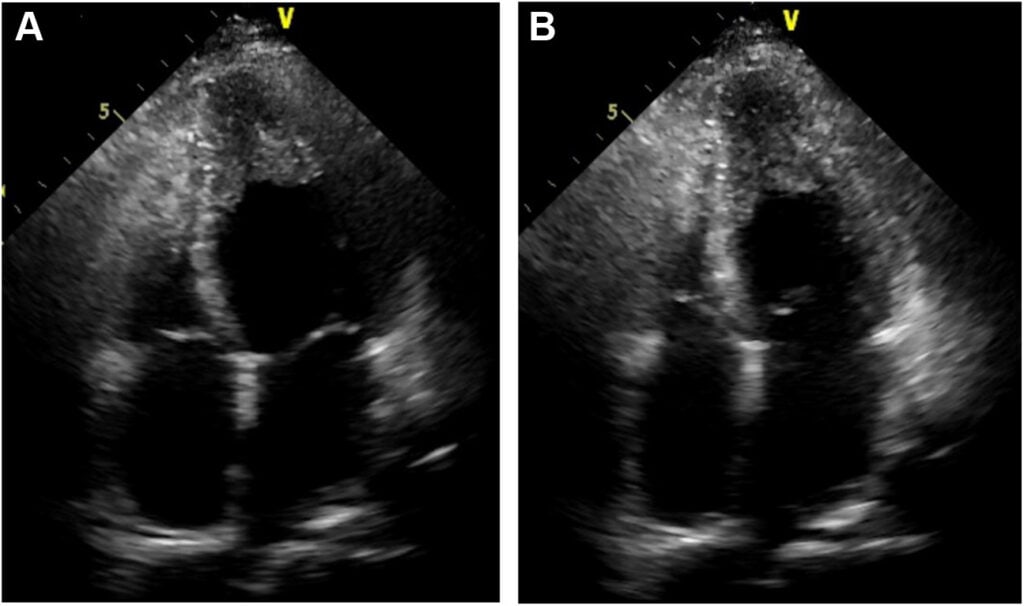
O diagnóstico diferencial ficou entre MCPH apical e endomiocardio fibrose, sendo a primeira hipótese considerada como a principal em razão da ausência de hipereosinofilia. O paciente, então, foi conduzido de forma expectante, com avaliação periódica dos níveis de eosinófilos.
Dois anos depois, o paciente apresentou disfunção cognitiva leve, alteração de fala e dificuldade de deglutição. Tomografia computadorizada de cérebro revelou infartos crônicos cerebelares bilaterais, em região occipital esquerda e também na região frontal.
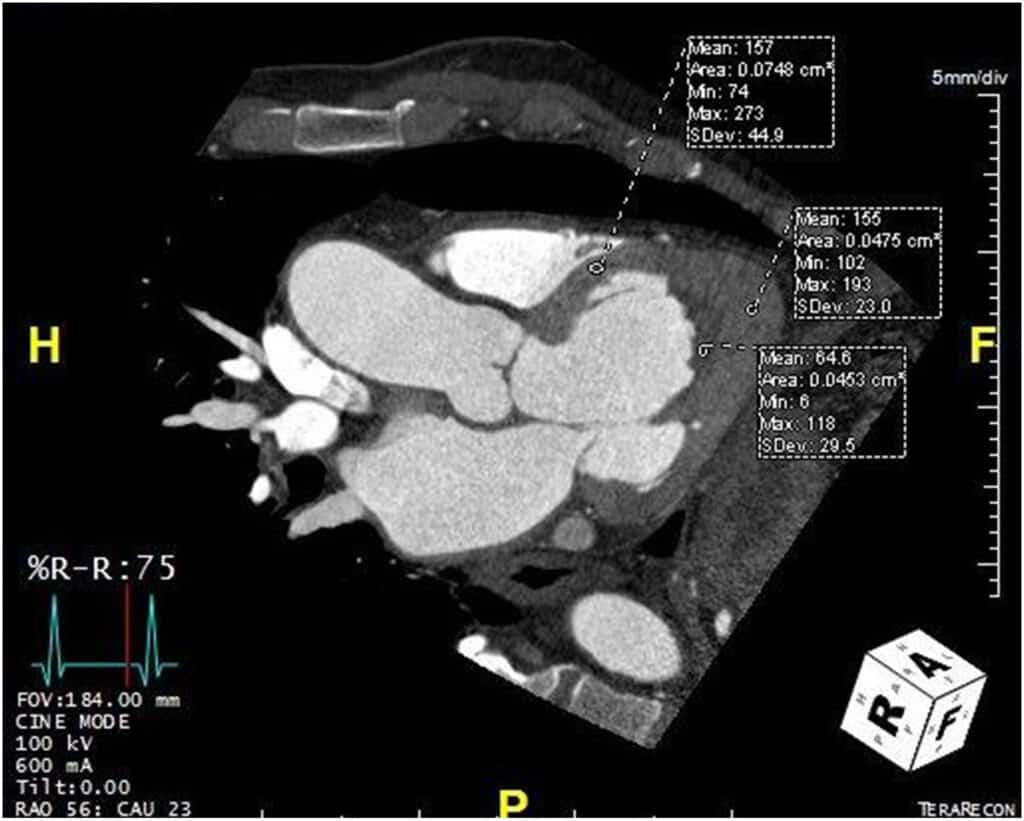
Havia, agora, aumento dos níveis séricos de eosinófilos (1.1 × 109 – normal: 0-0.5 × 109) e a tomografia computadorizada do coração mostrou defeitos de enchimento nas regiões apicais de ambos os ventrículos sugerindo a presença de trombos. Além disso, o ápice do VE tinha 13 mm de espessura, com valores de atenuação similares ao de um miocárdio saudável. Não havia doença arterial coronária obstrutiva.
Aspirado de medula óssea mostrou aumento leve de eosinófilos e de seus precursores, mas a análise citogenética afastou doenças mieloproliferativas ou malignidade.
Iniciado, então, doses elevadas de corticosteróides e anticoagulação direcionados para tratamento de endomiocardiofibrose associada a presença de trombo apical.
Alguns meses depois do início do tratamento, foi realizada RM cardíaca que demonstrou um ápice com 15 mm de espessura, normocontrátil e função sistólica biventricular normal. O VD não apresentava alterações.
A avaliação através da técnica de realce tardio mostrou dois padrões distintos: (1) realce subendocárdico na região apical do VE com presença do sinal em “V” consistente com endomiocardiofibrose (SETA PRETA) e (2) uma área focal pequena de realce no mesocárdio também região apical (SETA BRANCA).
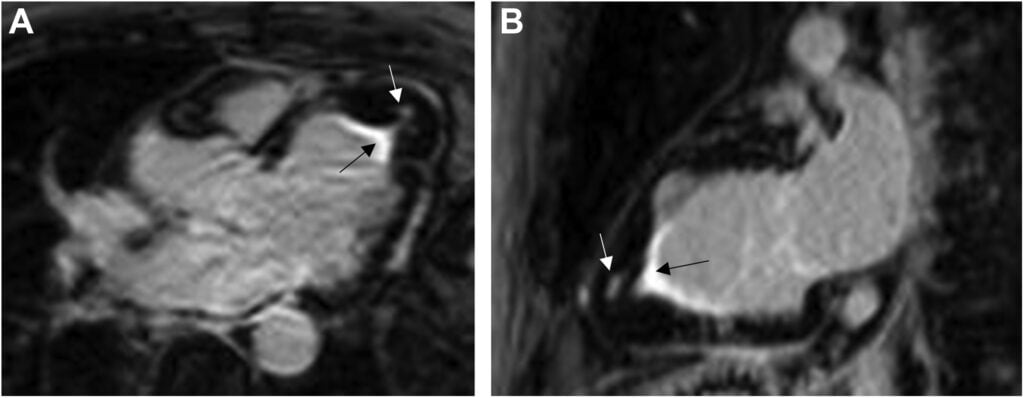
Esse realce focal isolado é o padrão habitualmente encontrado na CMPH apical, o que levou à suspeita de se tratar de duas doenças coexistindo.
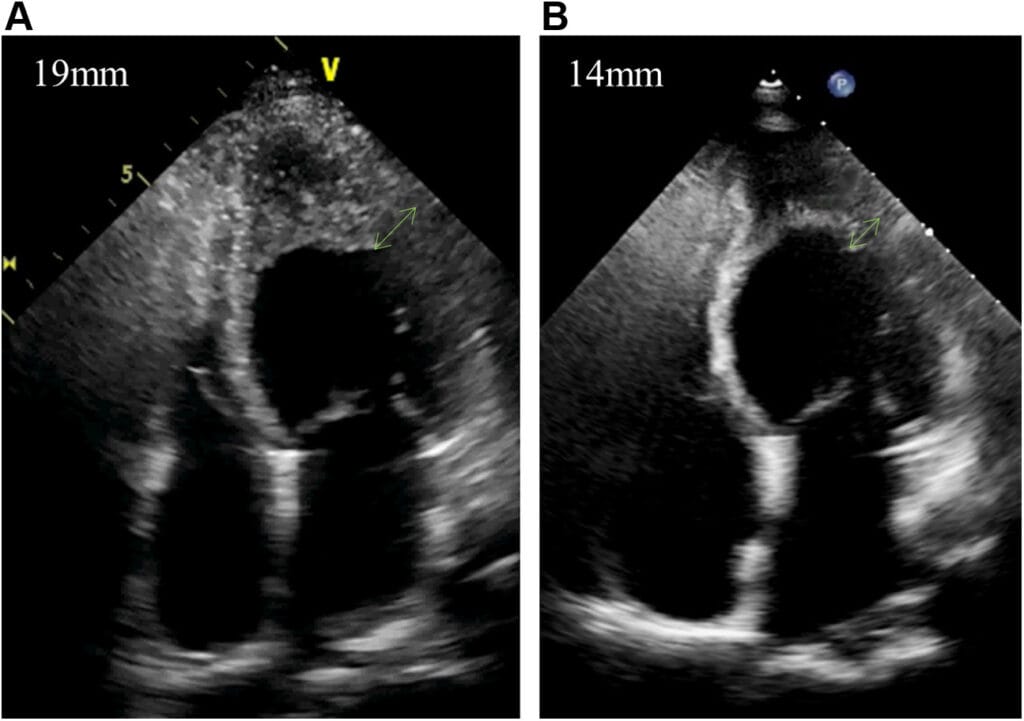
A avaliação ecocardiográfica durante o curso de corticosteróides demonstrou redução significativa do espessamento apical do VE (19 mm –> 14 mm).
Graduado em medicina pela Universidade Potiguar (UnP). Possui residência em Clínica Médica pelo Hospital Universitário Onofre Lopes – HUOL (UFRN) e em Cardiologia pelo Procape – UPE. Porta o título de especialista em Cardiologia pela Sociedade Brasileira de Cardiologia (SBC) e é pós-graduado em Ecocardiografia, pela ECOPE.

Meu caso é bem parecido com esse. Hipertrofia apical ventrículo esquerdo. Culminando com trombo no ápice. Infelizemente causando dois AVC’s. Pós ressonância magnética coração. Descoberto trombo na região apical. Tratamento com apixabana. Segundo ultrasson parece que o trombo não existe mais. Mas nosso médico optou a continuar com apixabana.