Echocardiographic evaluation of patients with patent foramen ovale and cryptogenic stroke.
Nome abreviado: Forame Oval Patente e AVC criptogênico.
Carlos Antônio da Mota Silveira, José Maria Del Castillo.
Pronto Socorro Cardiológico de Pernambuco, UPE.
Escola de Ecografia de Pernambuco.
Carlos Antônia da Mota Silveira.
Curriculum Lattes: http://lattes.cnpq.br/8597729612039372.
Avenida Flor de Santana, 167 Ed. Natália, apto 201. 52060-290. Recife, PE.
Telefone +55 81 99979-9412
E-mail: cantonio2@terra.com.br
José Maria Del Castillo, ORCID 0000-0002-2214-203X
Curriculum Lattes: http://lattes.cnpq.br/4922446519082204.
Rua Jorge de Lima, 245 apto 303 Salute. 51160-070 – Recife, PE.
Telefone +55 81 98163-4155.
E-mail: castillojmd@gmail.com
Tópicos
Resumo
Recentes estudos indicaram que o forame oval patente (FOP) pode ser responsável por acidente vascular cerebral criptogênico (AVC) em pacientes jovens que apresentam condições anatômicas favoráveis a esta anomalia e que a oclusão transcatéter reduz a incidência de AVC quando comparado ao tratamento clínico. A injeção de soro agitado durante o estudo ecocardiográfico, associado à manobra de Valsalva, pode evidenciar shunt direita-esquerda com alta sensibilidade (89%) e especificidade (92%) quando se utiliza o ecocardiograma transesofágico. Avaliando as características clínicas de pacientes com AVC e FOP, o trial RoPE (Risk of Paradoxical Embolism) estabeleceu um escore de risco para AVC criptogênico e, por meio de um modelo de regressão multivariada, identificou 6 variáveis: idade, presença de isquemia cortical, diabetes, hipertensão, AVC e acidente isquêmico transitório prévio. Os escores mais elevados foram observados em jovens com AVC e sem fatores de risco vascular e os escores mais baixos em idosos com fatores de risco vascular, onde o FOP sugere ser acidental. Condições anatômicas do FOP predispõem a embolia sistêmica (separação do FOP >2mm, túnel do FOP >10 mm, ângulo entre a veia cava inferior e o flap do FOP <10 graus, intensidade do shunt com manobra de Valsalva, presença de aneurisma do septo interatrial e rede de Chiari ou válvula de Eustáquio proeminente). O fechamento do FOP pode prevenir a embolia paradoxal reduzindo a incidência de AVC em pacientes considerados com risco elevado.
Descritores: acidente vascular cerebral, forame oval patente, ecocardiografia.
Summary
Recent studies have indicated that the patent foramen ovale (PFO) may be responsible for cryptogenic stroke in young patients with anatomical conditions favourable to this anomaly and that transcatheter occlusion reduces the incidence of stroke when compared to clinical treatment. The injection of agitated saline during the echocardiographic study, associated with the Valsalva maneuver, may show right-to-left shunt with high sensitivity (89%) and specificity (92%) when using the transesophageal echocardiogram. Evaluating the clinical characteristics of patients with stroke and PFO, the RoPE (Risk of Paradoxical Embolism) trial established a risk score for cryptogenic stroke and, using a multivariate regression model, identified 6 variables: age, presence of cortical ischemia, diabetes, hypertension, stroke or previous transient ischemic attack. The highest scores were observed in young people with stroke and without vascular risk factors and low scores in elderly people with vascular risk factors, where PFO suggests being accidental. Anatomical conditions of the PFO predispose to systemic embolism (PFO separation >2mm, PFO tunnel >10 mm, angle between the inferior vena cava and the PFO flap <10 degrees, shunt intensity with Valsalva maneuver and presence of interatrial septal aneurysm and Chiari network or prominent Eustachian valve). PFO closure can prevent paradoxical embolism by reducing the incidence of stroke in patients considered to be at high risk.
Descriptors: stroke, patent foramen ovale, echocardiography.
Artigo de Revisão
A relação entre acidente vascular cerebral (AVC) criptogênico e a presença de forame oval patente (FOP) tem despertado particular interesse, baseado em estudos recentes que demonstraram que a oclusão transcatéter do FOP reduziu a incidência de AVC criptogênico, quando comparado ao tratamento medicamentoso (1).
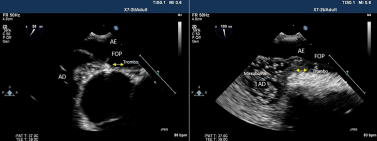
Trombos atravessando o forame oval podem ser observados em exames ecocardiográficos e em autopsias, confirmando este mecanismo como responsável pela embolia paradoxal, ou seja, um trombo venoso passando para a circulação arterial por um shunt direita-esquerda. Entretanto, esta visualização ecocardiográfica é rara e existem poucos estudos publicados (2,3) (ver Figura 1).
Alguns estudos clínicos demonstram a propensão do FOP ser o responsável pela embolia paradoxal. Pacientes portadores de diabetes, hipertensão arterial sistêmica e doença arterial coronária, tem baixa prevalência para o FOP ser o responsável pela embolia paradoxal. Por outro lado, história de trombose venosa profunda, embolia pulmonar, hipertensão pulmonar, viagens prolongadas, manobra de Valsalva precedendo o início de sintomas de AVC, enxaqueca, apneia do sono, têm sido descritos como fatores de risco independentes para a associação entre FOP e eventos cerebrovasculares (4).
Mesmo sendo pouco frequente a visualização de trombos em forame oval, a observação epidemiológica nos leva a acreditar que o FOP é o responsável por um número considerável de acidentes vasculares cerebrais (5).
A prevalência de FOP em um estudo com autopsia em 965 corações normais é de 27%, com similar distribuição entre homens e mulheres. Esta prevalência declina com a idade, sendo de 34% em menores de 30 anos, 25% entre 30 e 80 anos e 20% em maiores de 80 anos (6). Em pacientes com AVC criptogênico, entretanto, a prevalência é particularmente elevada, chegando a 40% em pacientes com idade inferior a 55 anos (7).
É importante ressaltar que a presença de FOP em pacientes com AVC criptogênico não é a única etiologia para o embolismo paradoxal. Outros mecanismos podem ser responsáveis, como fibrilação atrial não detectada, tumores cardíacos (mixoma, fibroeslastomas), presença de contraste ecocardiográfico espontâneo em átrio esquerdo, valvopatia mitral reumática, calcificação do anel valvar mitral, próteses cardíacas biológicas e mecânicas, estados de hipercoagulabilidade, ateroma de aorta ascendente (8).
O estudo ecocardiográfico é parte da rotina na avaliação do FOP, principalmente o ecocadiograma transesofágico (ETE) com utilização de solução salina agitada (macrobolhas). Considera-se um shunt pequeno quando passam de 3 a 10 bolhas, médio de 10 a 30 bolhas e grande mais de 30 bolhas contados nos primeiros batimentos após a injeção (9).
Ademais da detecção do shunt, o ETE avalia as características anatômicas do FOP, assim como o diagnóstico diferencial com a comunicação interatrial e com o shunt pulmonar (10,11). Trabalhos comparando o ETE utilizando macrobolhas com os achados de autópsia mostram sensibilidade de 89% e especificidade de 92%, sendo que a autópsia é considerada padrão ouro (12).
A realização de uma manobra de Valsalva eficiente quando se utiliza a solução com macrobolhas é extremamente importante. Com frequência este aspecto é negligenciado, principalmente quando o exame é realizado com sedação profunda, o que pode resultar em um exame falso negativo. Se recomenda a sedação superficial ou o uso apenas de anestesia local orofaríngea, quando da utilização de injeção da solução de macrobolhas para pesquisa de FOP (13).
O Doppler transcraniano tem demonstrado ser mais sensível, porém menos específico, que o ETE no diagnóstico de FOP. Sua insensibilidade de fazer diagnóstico diferencial entre shunt cardíaco e pulmonar, além da limitação no diagnóstico das alterações anatômicas que favorecem a presença de FOP, como a presença de aneurisma de septo interatrial e mobilidade do septo, justificam esta menor especificidade (14).
Em relação a melhor opção terapêutica para os pacientes com AVC criptogênico (terapia medicamentosa ou fechamento percutâneo), no CLOSURE TRIAL de 2012 (15), e no RESPECT (16) e PC TRIAL (17) de 2013, não foram demonstrados benefícios da terapia percutânea para fechamento do FOP em relação à terapia medicamentosa. Em 2017, porém, uma mudança de conduta terapêutica foi determinada pelos ensaios randomizados CLOSE (18), REDUCE (19) e RESPECTt (20), que demonstraram ser o fechamento percutâneo do FOP superior ao tratamento medicamentoso na prevenção de AVC criptogênico em população específica. Após esta mudança de conduta, nos últimos anos, vários estudos procuraram aperfeiçoar e determinar com maior precisão quais pacientes tem maior probabilidade de serem
beneficiados com o tratamento intervencionista.
O estudo RISK OF PARADOXICAL EMBOLISM (RoPE) (21), avaliou as características clínicas de pacientes com AVC criptogênico e FOP, e propôs um escore de risco, estratificando pacientes pela idade e presença ou ausência de fatores de risco vascular. Usando dados clínicos e radiológicos de 3000 pacientes, um modelo de regressão multivariada identificou 6 varáveis associadas a AVC criptogênico, criando um escore com 10 pontos para estratificar a probabilidade da presença de um FOP estar associado a um AVC ou de ser um evento acidental. As variáveis analisadas incluíram idade, presença de AVC cortical em estudo de imagem, e presença ou ausência dos seguintes fatores: diabetes, hipertensão arterial sistêmica, AVC ou ataque isquêmico transitório prévio. O escore de risco foi calculado com estas dez variáveis, sendo estimado para um período de 2 anos em cada grupo. (Tabela 1).
Tabela 1 – ESCORE RoPE (Risk of Paradoxical Embolism) (21).
Características Pontos
Ausência de história de Hipertensão 1 Ausência de história de Diabetes 1 Ausência de história de AVC ou AIT 1 Não tabagista 1 Infarto de AVCi cortical na imagem (TC ou RM) 1 Idade (anos)
De 18 a 29 5 De 30 a 39 4 De 40 a 49 3 De 50 a 59 2 De 60 a 69 1 Mais de 70 0
AVC: acidente vascular cerebral; AIT: acidente isquêmico transitório, TC: tomografia computadorizada; RM: ressonância magnética.
Pacientes jovens, com AVC superficial e sem fatores de risco vasculares, apresentam escore elevado. A prevalência de FOP aumenta de 23% nos pacientes com 0 a 3 pontos para 73% nos pacientes com 9 a 10 pontos. Escores elevados são observados em pacientes jovens com poucos ou sem os fatores de risco tradicionais que apresentam infartos cerebrais superficiais. Em pacientes com escores baixos, idosos, com fatores de risco vasculares, a presença de FOP sugere ser acidental. O risco de AVC ou ataque isquêmico transitório em 2 anos é calculado para cada grupo (22) (Tabela 2).
Tabela 2 – Risco de AVC (22)
Total de Pontos Risco do AVC ser relacionado ao FOP 0 a 3 0%
4 38%
5 34%
6 62%
7 62%
8 84%
9 a 10 88%
AVC: acidente vascular cerebral; FOP: forâmen oval permeável.
Um estudo recente demonstrou que algumas características anatômicas do FOP predispõem a formação e passagem de trombos do átrio direito para o esquerdo sendo a causa de embolias sistêmicas (23).
1. Largura do FOP: a separação máxima entre o septum primum e o septum secundum é considerada grande quando >2 mm. Um estudo comparando 58 pacientes submetidos a oclusão de FOP após sofrer AVC criptogênico e em 58 pacientes com FOP assintomáticos, avaliados por ETE, observou FOP mais largos, no grupo com AVC (p <0.001) (24).
2. Túneis longos, >10mm, ocorrem com maior frequência em pacientes com AVC criptogênico (46% vs 17%, P< 0.01).
3. O grau do shunt direita-esquerda é avaliado em repouso e após manobra de Valsalva, utilizando-se contraste com solução salina agitada. O número de macrobolhas é contado em um único frame, e quando é superior a 20 macrobolhas é considerado um shunt importante, com maior risco de AVC (16% vs 5% p < 0.06).
4. O ângulo entre a veia cava inferior (VCI) e o flap do forame oval, também deve ser medido. Um ângulo inferior a 10 graus é considerado de maior risco para AVC.
5. O aneurisma do septo interatrial é definido pela presença de tecido redundante, móvel, na região da fossa oval, com excursão fásica de 10 a 15 mm durante a respiração (25). Sua prevalência, avaliada com ETE, é de 2,2% na população geral (26). Há elevada prevalência de aneurisma de septo em pacientes com AVC, variando de 7,9% a 15%, em pacientes com possível AVC embólico, e em 28% dos pacientes com evento cerebral isquêmico e artérias carótidas normais (27). Dois mecanismos têm sido propostos como responsáveis pela embolia paradoxal causada por aneurisma ou hipermobilidade do septo interatrial.
a) Como este aneurisma é frequentemente associado a FOP, a embolia paradoxal ocorreria pela passagem do trombo do átrio direito para o átrio esquerdo, através do FOP (Figura 1). Um shunt intracardíaco tem sido observado em 78% dos pacientes com aneurisma. Em 54 a 84% dos pacientes com AVC e aneurisma de septo, também há shunt interatrial devido a FOP.
b) Em pacientes com aneurisma do septo interatrial sem shunt intracardíaco, pequenos trombos de fibrina e plaquetas podem se formar no lado esquerdo do septo, desprendendo-se com a oscilação do aneurisma, causando embolia sistêmica (Figura 2A).
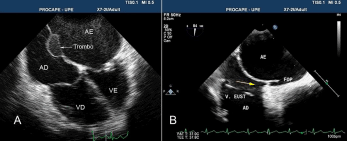
6. Válvula de Eustáquio e Rede de Chiari. A válvula de Eustáquio está localizada na junção entre a veia cava inferior e o átrio direito, e em alguns indivíduos é redundante (Figura 2B). A rede de Chiari consiste em uma malha de estruturas filamentosas e fibrosas no átrio direito, originadas da região das válvulas de Eustáquio e Tebésio, próxima ao orifício da veia cava inferior, inserida na parede do átrio direito ou no septo interatrial. Um estudo de revisão de 1436 ecocardiogramas transesofágicos detectou presença de rede de Chiari em 2% dos exames, dos quais 83% apresentavam FOP e 27% aneurisma de septo interatrial. A rede de Chiari ocorre com maior frequência em pacientes que realizaram ETE por AVC criptogênico do que em estudos realizados por outras indicações. (4,6% vs 0,5%) (28). Estas estruturas podem direcionar o fluxo que chega pela veia cava inferior diretamente para o septo interatrial, favorecendo a persistência do forame oval e do aneurisma do septo interatrial, e indiretamente facilitando a embolia paradoxal. Um FOP com grande shunt direita-esquerda foi observado com maior frequência nos pacientes que tinham rede de Chiari (55% vs 12%) (29).
A análise multivariada de estas observações evidenciou que pacientes com FOP e AVC criptogênico tem FOP mais largos (>2mm), mais extensos ( >10mm) (Figura 3A e 3B), septos interatriais mais móveis, válvulas de Eustáquio e rede de Chiari proeminentes e ângulo entre o FOP e a VCI <10 graus (Figura 3C). Estes fatores são preditores independentes de eventos cerebrais isquêmicos (23)(Tabela 3). Baseado nesses dados anatômicos analisados pela ecocardiografia, foi elaborado um escore de risco para o FOP ser responsável pela embolia paradoxal em pacientes que apresentarem AVC (Tabela 4).

Tabela 3 – Cálculo de risco de AVC provocado por FOP (23).
Variáveis Pontos
Túneis longos do FOP > 10 mm 1 Hipermobilidade do septo interatrial 1 Extensa válvula de Eustáquio ou Rede de Chiari 1 Grande Shunt durante manobra De Valsalva 1 Ângulo FOP-VCI < 10 graus 1 AVC: acidente vascular cerebral; FOP: forame oval patente; VCI: veia cava inferior.
Tabela 4 – Risco de AVC.
Escore Risco de AVC
Escore 0 5%
Escore 1 17%
Escore 2 80%
Escore 3 87%
Escore 4 89%
AVC: acidente vascular cerebral.
Escores elevados são observados em pacientes jovens com infartos cerebrais superficiais sem ou com poucos fatores de risco tradicionais. Pacientes com escores baixos, idosos, com fatores de risco vascular, sugerem que a presença de FOP é acidental e não diretamente responsável pelo evento isquêmico. O risco de ocorrer AVC ou ataque isquêmico transitório é calculado para um período de 2 anos.
Conclusão
O fechamento percutâneo do FOP pode prevenir a embolia paradoxal e reduzir o risco de AVC criptogênico recorrente em grupos de pacientes avaliados como de risco elevado. Para tal, escores de risco foram desenvolvidos na tentativa de determinar quais pacientes serão beneficiados com a terapêutica intervencionista. O primeiro estudo observacional avaliando dados anatômicos pelo ecocardiografia transesofágica, permitiu elaborar um escore de risco que determina quais pacientes portadores de FOP podem apresentar AVC criptogênico, nos quais haveria indicação de fechamento percutâneo(23).
Com estes parâmetros ecocardiográficos de avaliação do FOP abre-se uma nova perspectiva no diagnóstico, prognóstico e indicação terapêutica em pacientes jovens com risco de AVC criptogênico e mesmo em pacientes com idade superior a 60 anos.
Referências bibliográficas
1. Mojadidi MK, Elgendy AY, Elgendy IY, et al. Transcatheter patent foramen ovale closure after cryptogenic stroke: an updated meta-analysis of randomized trials. JACC Cardiovasc Interv 2017; 10:2228–2230. 2. Baydoun H, Barakat I, Hatem E, et al. Thrombus in transit through patent foramen ovale. Case Rep Cardiol 2013; 2013:395879.
3. Lu C, Li J, Wang W, et al. Large thrombus-in-transit within a patent foramen ovale in a patient with pulmonary embolism: a case report. J Intern Med Res 2018; 46(10):4332-4337.
4. Ozdemir AO, Tamoyo A, Munoz C, et al. Cryptogenic stroke and patent foramen ovale: clinical clues to patent foramen ovale. J Neurol Sci 2008; 275:121-127.
5. Homma S, Sacco RL. Patent foramen ovale and stroke. Circulation 2005; 112:1063-1072. 6. Lechat P., Mas JL, Lascault G, et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988; 318:1148–1152.
7. Hara H, Virmani R, Ladich E, et al. Patent foramen ovale: current pathology, pathophysiology, and clinical status. J Am Coll Cardiol 2005; 46:1768–1776
8. Ay H, Benner T, Arsava EM, et al. A computerized algorithm for etiologic classification of ischemic stroke: The Causative Classification of Stroke System. Stroke 2007; 38:2979-2984.
9. Stewart MJ. Contrast echocardiography. Heart 2003; 89:342-348.
10. Mojadidi MK, Mahmoud AN, Elgendy IY, Agarwal N, Tobis JM et al. Transesophageal echocardiography for the detection of patent foramen ovale. J Am Soc Echocardiogr 2017; 30:933–934.
11. Chessa M, Drago M, Krantunkov P et al. Differential diagnosis between patent foramen ovale and pulmonary arteriovenous fistula in two patients with previous cryptogenic stroke caused by presumed paradoxical embolism. J Am Soc Echocardiogr 2002; 15:845-846.
12. Mojadidi MK, Bogush N, Caceres JD et al. Diagnostic accuracy of transesophageal echocardiogram for the detection of patent foramen ovale: A meta-analysis. Echocardiography 2013; 00:1-7. 13. Wei D, Ju Y. Importance of an adequately performed Valsalva maneuver for detecting a right-to-left shunt indicating foramen ovale reopening. J Ultrasound Med 2015; 34:879-883.
14. Mojadidi MK, Roberts SC, Winoker JS, et al. Accuracy of transcranial Doppler for the diagnosis of intracardiac right-to-left shunt: a bivariate meta-analysis of prospective studies. J Am Coll Cardiol Imaging 2014; 7:236– 250.
15. Furlan AJ, Reisman M, Massaro J, et al. Closure or medical therapy for cryptogenic stroke with patent foramen ovale. N Engl J Med 2012; ;366(11):991-999.
16. Carroll JD, Saver JL, Thaler DE, et al. Closure of patent foramen ovale versus medical therapy after cryptogenic stroke. N Engl Med. 2013; 368(12):1092-1100.
17. Meier B, Kalesan B, Mattle HP, et al. Percutaneous closure of patent foramen ovale in cryptogenic embolism. N Engl J Med. 2013; 368(12):1083-1091.
18. Mas JL, Derumeaux G, Guillon B, et al. Patent foramen ovale closure or anticoagulation vs. antiplatelets after stroke. N Engl J Med 2017; 377(11):1011-1021.
19. Sondergaard L, Kasner SE, Rhodes JF, et al. Patent foramen ovale closure or antiplatelet therapy for cryptogenic stroke. N Engl J Med 2017; 377(11):1033-1042.
20. SaverJL, Carroll JD, Thaler DE, et al. Long-term outcomes of patent foramen ovale closure or medical therapy after stroke. N Engl J Med 2017; 377(11):1022-1032.
21. Thaler DE, Di Angelantonio ED, Di Tullio MR et al. The risk of paradoxical embolism (RoPE) study: initial description of the completed database. Int J Stroke 2013; 8(8):612-619.
22. Kent DM, Ruthazer R, Weimar C, et al. An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology 2013; 81:619.
23. Nakayama R, Takaya Y, Akagi T et al. Identification of high-risk patent foramen ovale associated with cryptogenic stroke: development of a scoring system. J Am Soc Echocardiogr 2019; 32(7).811-816. 24. Goel SS, Tuzcu EM, Shishehbor MH, et al. Morphology of the patent foramen ovale in asymptomatic versus symptomatic (stroke or transient ischemic attack) patients. Am J Cardiol 2009; 103:124-129. 25. Pearson AC, Nagelhout D, Castello R, et al. Atrial septal aneurysm and stroke: a transesophageal echocardiographic study. J Am Coll Cardiol 1991; 18:1223-1229.
26. Agmon Y, Khandheria BK, Meissner I, et al. Frequency of atrial septal aneurysms in patients with cerebral ischemic events. Circulation 1999; 99:1942-1944.
27. Mattioli AV, Aquilina M, Oldani A, et al. Atrial septal aneurysm as a cardioembolic source in adult patients with stroke and normal carotid arteries. A multicentre study. Eur Heart J 2001; 22(3):261-268. 28. Schneider B, Hofmann T, Justen MH, Meinertz T. Chiari’s network: normal anatomic variant or risk factor for arterial embolic events? J Am Coll Cardiol 1995; 26:203-210. 29. Rigatelli G, Dell’Avvocata F, Braggion G, et al. Persistent venous valves correlate with increased shunt and multiple preceding cryptogenic embolic events in patients with patent foramen ovale: an intracardiac echocardiographic study. Catheter Cardiovasc Interv 2008; 72:973

É doutor em medicina, especialista em Cardiologia (SBC) e especialista em Ecocardiografia.
Curriculum completo disponível na Plataforma Lattes
(http://lattes.cnpq.br/4922446519082204)
Excelente trabalho, com grande objetividade e boa didática.