Já falamos, em diversas postagens, sobre associação do prolapso da valva mitral (VMi) e eventos arrítmicos, bem como dos achados ecocardiográficos que podem identificar aqueles pacientes sob maior risco de eventos negativos.
Trago um estudo que avaliou a associação dos mecanismos relacionados ao prolapso mitral arrítmico com (1) fibrose miocárdica e (2) arritmias.
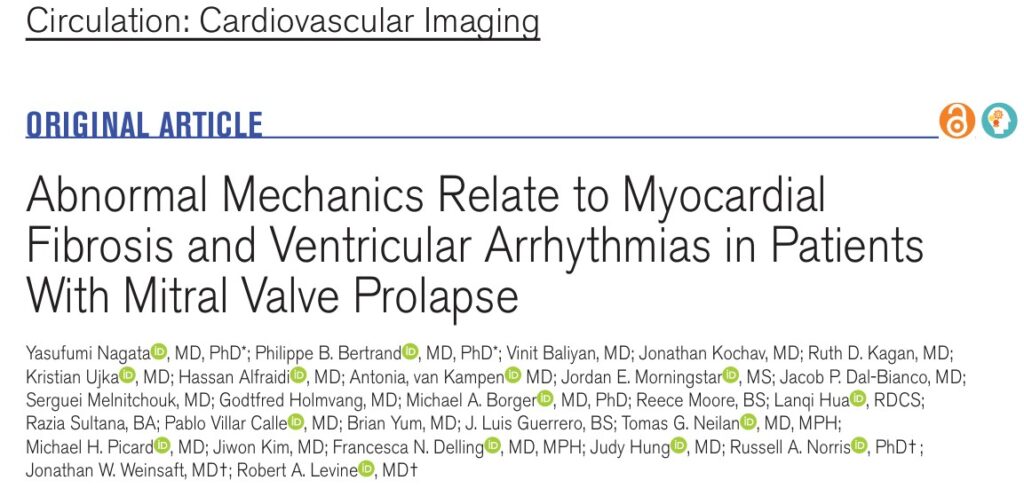
Estudo com pacientes portadores de prolapso de VMi que realizaram ressonância magnética (RM) cardíaca, bem como ecocardiograma, e que preencheram critérios para prolapso valvar tanto pela RM quanto pela ecocardiografia.
Os critérios de exclusão foram: (1) outra doença cardíaca associada, (2) déficit contrátil segmentar não justificado pela presença do prolapso, (3) imagem inadequada para a realização do strain e (4) idade < 18 anos.
Um grupo controle (n = 20) foi composto por indivíduos sem doenças ou fatores de risco cardiovasculares e que realizaram estratificação cardíaca antes de cirurgias não cardíacas ou quimioterapia.
Para estabelecer que a presença de fibrose na parede ínfero lateral se relaciona com as alterações da mecânica cardíaca do ventrículo esquerdo (VE) e dos músculos papilares (MP) pelo prolapso, 20 outros pacientes sem prolapso da valva mitral (PVM), mas com fibrose na mesma região foram inclusos na análise.
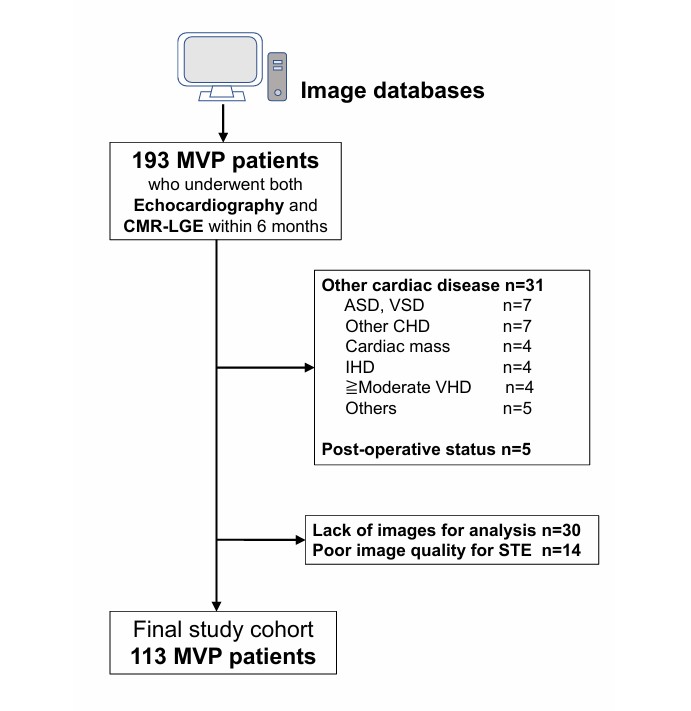
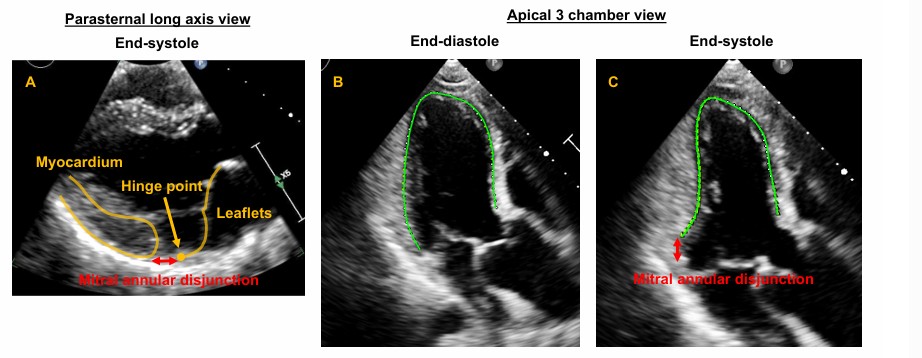
O prolapso foi definido como um deslocamento sistólico posterior (superior) do folheto valvar avaliado na janela paraesternal longitudinal eixo longo a partir do plano do anel mitral até o ponto mais superior do folheto prolapsado.
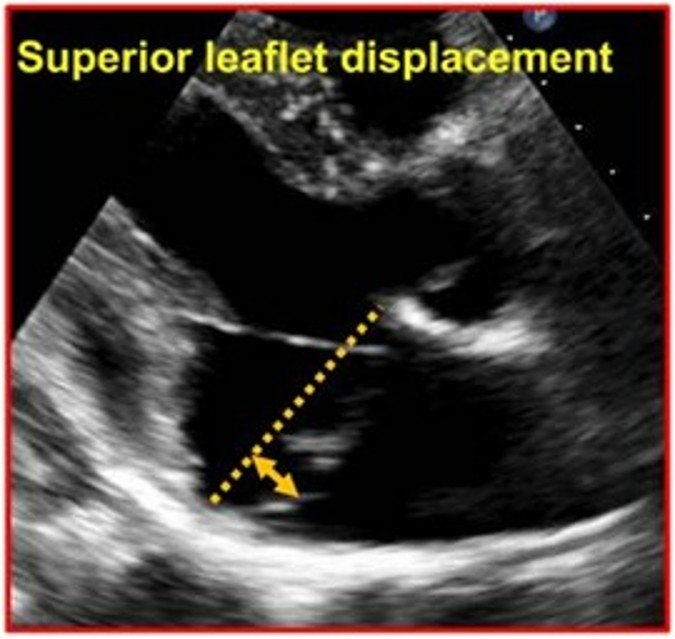
A disjunção do anel valvar (MAD) foi considerada como presente quando houve separação entre a borda posterior do miocárdio e a junção do folheto posterior com o átrio esquerdo (AE).
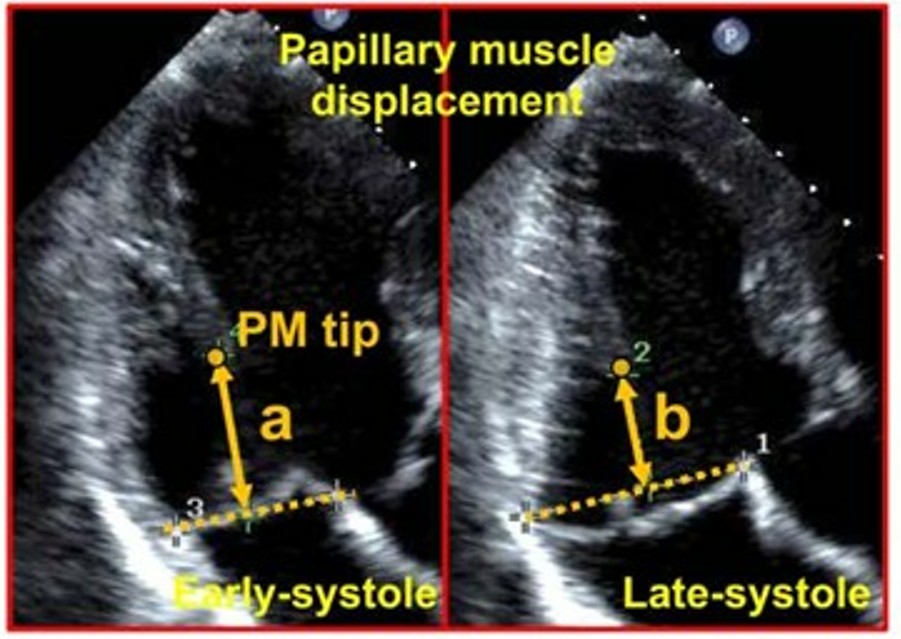
O deslocamento do músculo papilar foi medido pela variação da distância entre a ponta do mesmo e o plano do anel valvar mitral no início e no final da sístole ventricular.
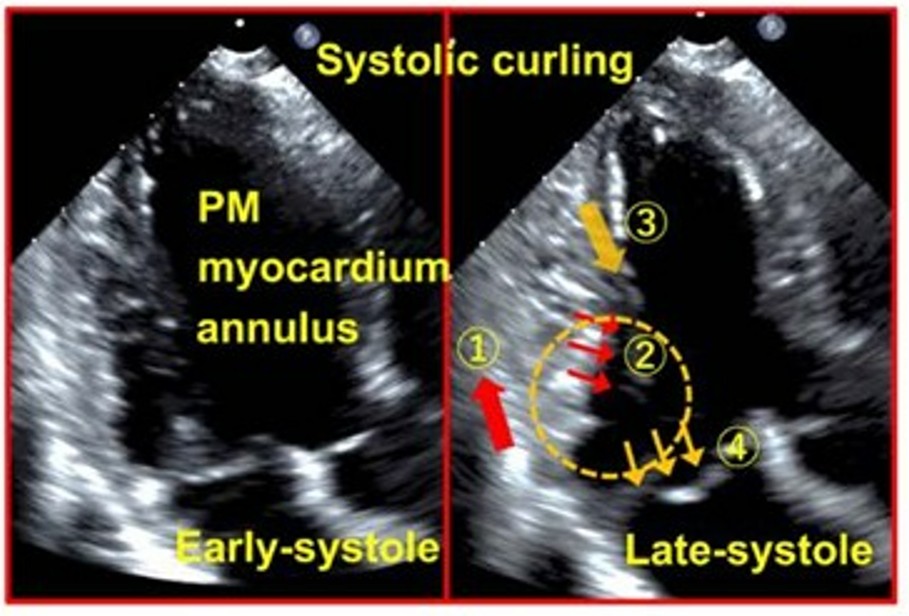
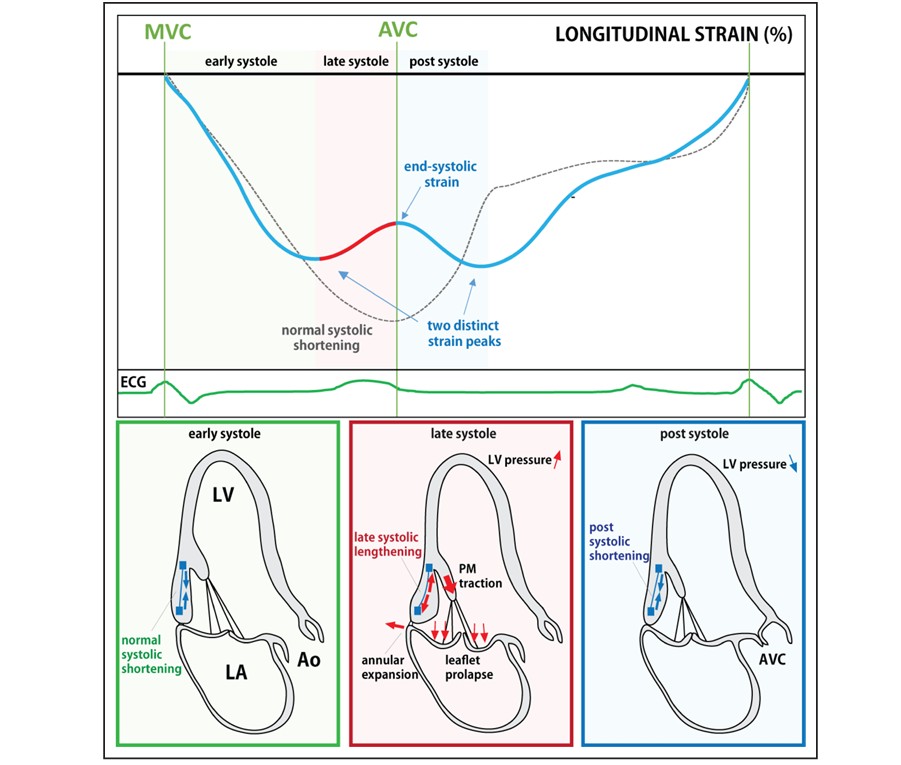
O curling consiste numa mobilidade exagerada do anel mitral posterior seguida de uma incursão miocárdica no segmento basal da parede ínfero lateral associado a um deslocamento superior do folheto posterior.
Em relação à análise do strain longitudinal, a borda endocárdica foi traçada manualmente com atenção para não incluir o segmento não muscular naqueles pacientes com MAD.
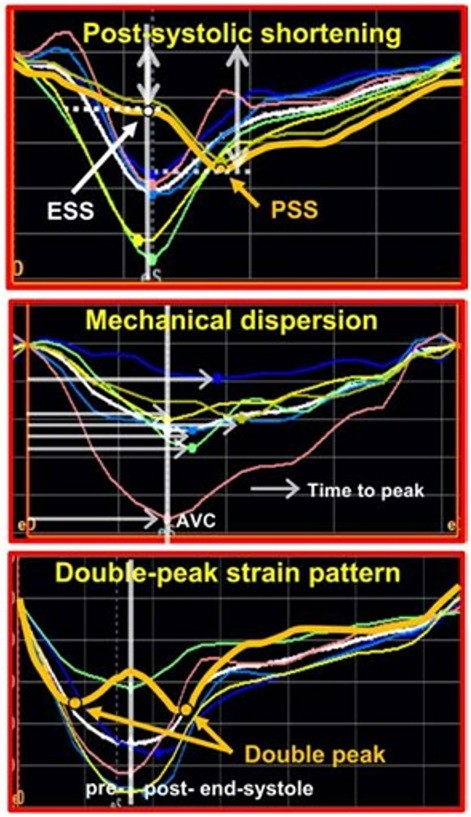
A análise dos traçados também foi realizada (é claro!) caracterizando contração pós-sistólica, índice de dispersão mecânica (PSD), bem com o padrão previamente descrito de dois picos sistólicos distintos do segmento basal da parede ínfero lateral.
O desfecho primário foi evento arrítmico significativo (taquicardia ventricular não sustentada -TVNS, taquicardia ventricular sustentada ou fibrilação ventricular). Extrassístoles ventriculares isoladas, em pares ou em salvas de 03 (com FC < 120 bpm) não foram consideradas.
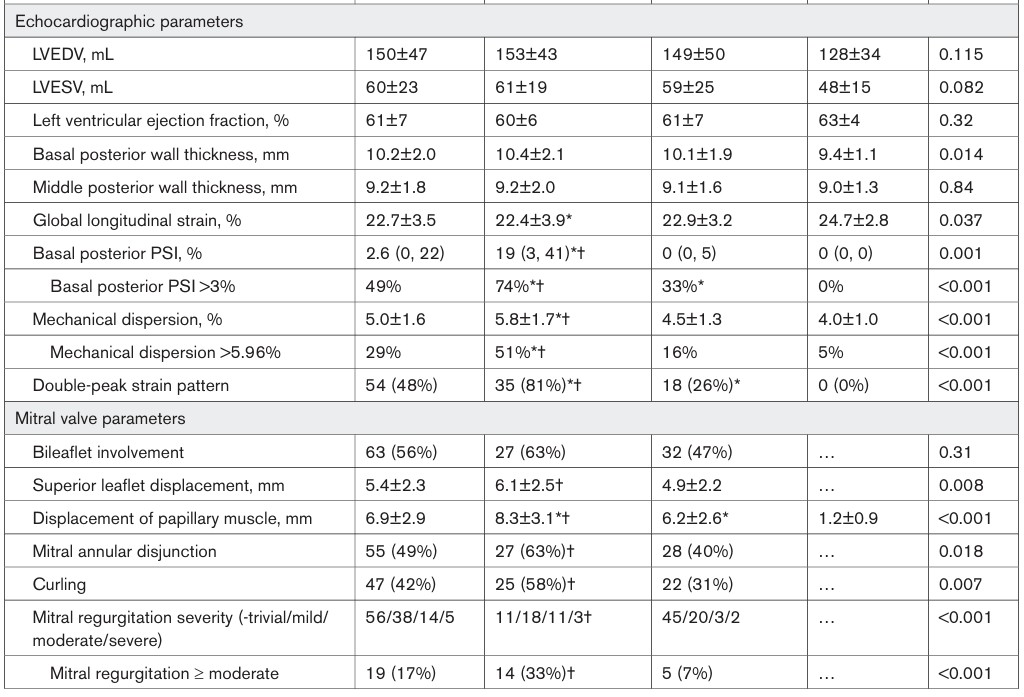
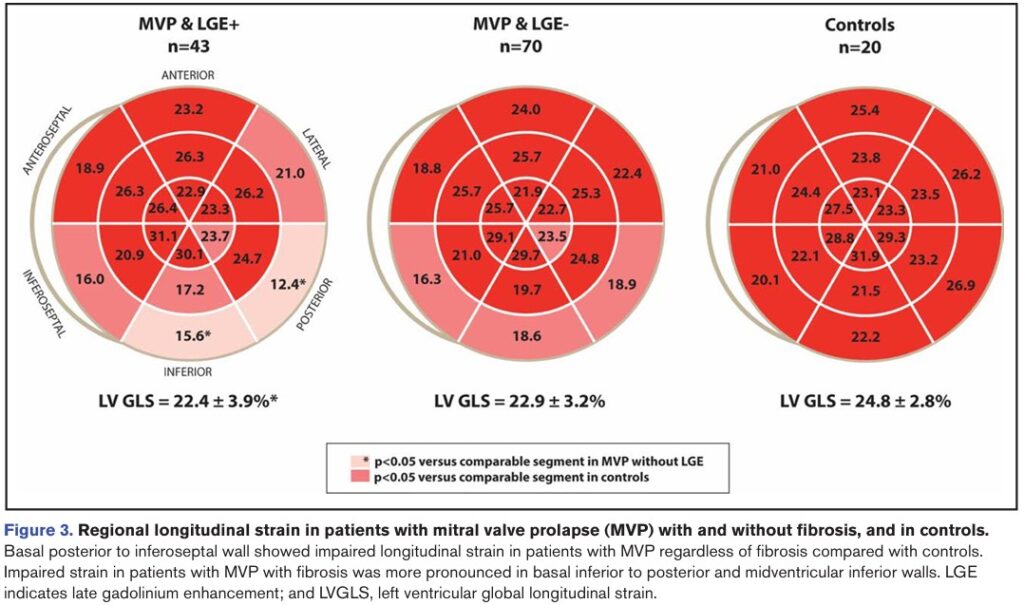
Comparado com o grupo controle, os pacientes com prolapso da valva mitral (PVM) apresentaram strain global longitudinal (SGL) menor e maior incidência de contração pós-sistólica, apesar de fração de ejeção (FE) do VE similar.
19 pacientes com PVM (17%) tinham regurgitação mitral ≥ moderada. O deslocamento sistólico do músculo papilar foi medido em 79 (70%) dos pacientes com prolapso mitral, sendo o valor médio de 6.9 ± 2.9 mm.
Contração pós-sistólica significativa, nos pacientes com PVM, foi observada apenas no segmento basal da parede ínfero lateral. o PSI (índice de contração pós-sistólica) excedeu 3% em 49% dos pacientes com PVM. A dispersão mecânica excedeu 5.96% do intervalo R-R em 29% da amostra.
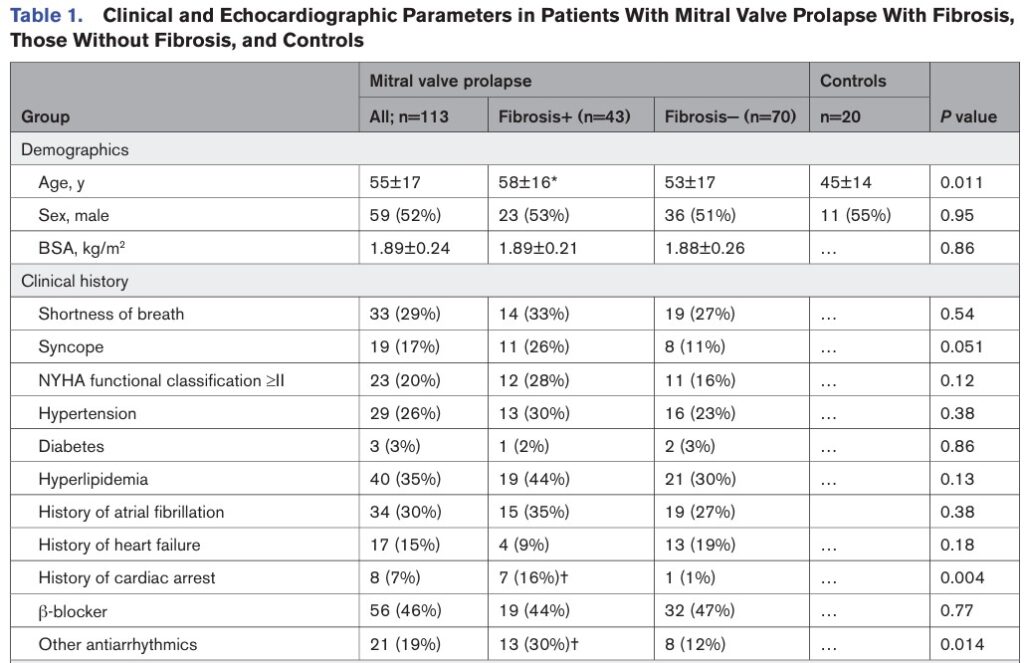

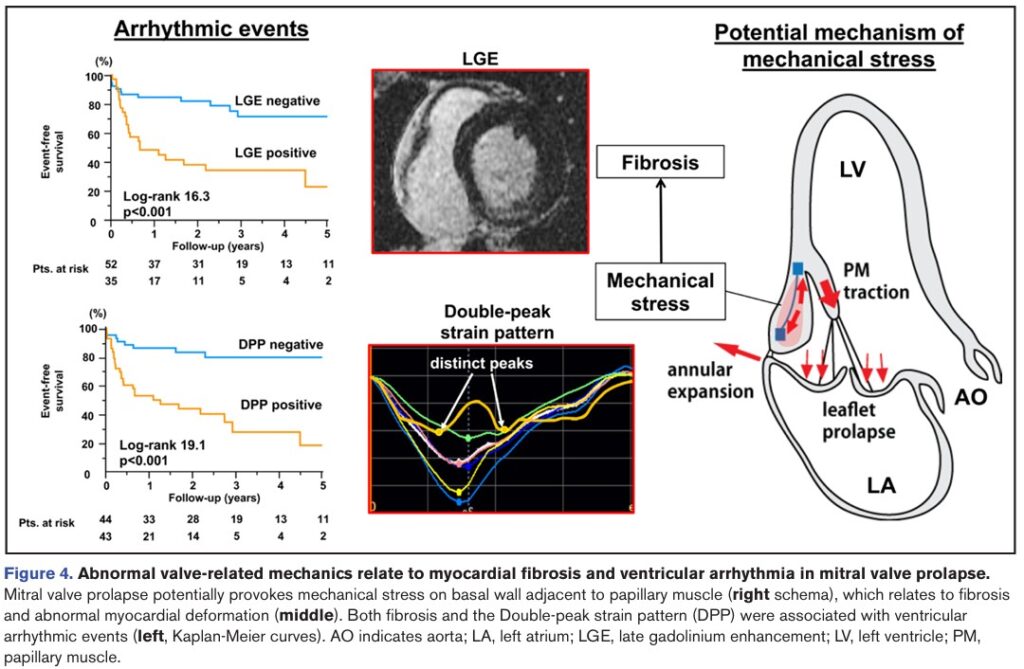
Fibrose miocárdica foi identificada, pela técnica de realce tardio, em 43 pacientes com PVM (38%), com localização predominante nos segmentos basal e médio da parede ínfero lateral ou nos músculos papilares.
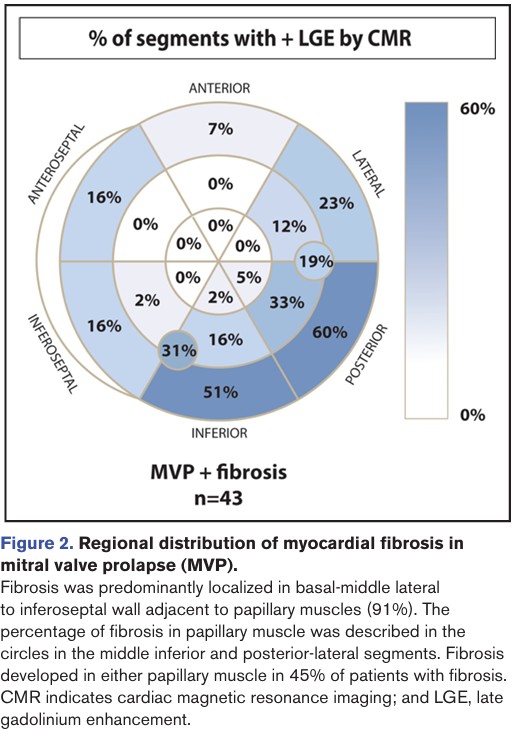
A maior parte dos pacientes teve fibrose mesocárdica isolada (58%), mas foi também observado um padrão misto com fibrose subendocárdica ou subepicárdica em 9% dos pacientes. O valor médio, em porcentagem, do realce tardio foi de 3.5% (1.6-6.5%) nos pacientes com PVM e fibrose.
Comparando pacientes com PVM com e sem fibrose miocárdica, as idades, sexo, volumes do VE, FE, espessura diastólica basal e média do VE, SGL e prevalência de prolapso de ambos os folhetos foram similares.
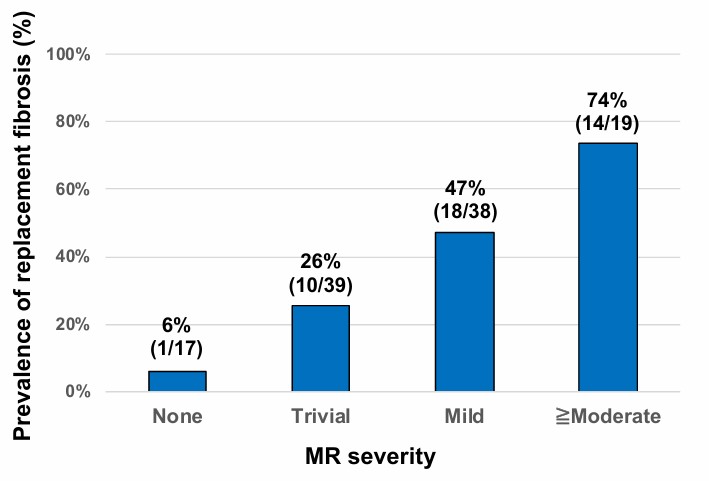
Contudo, os pacientes com PVM e fibrose miocárdica apresentaram maior deslocamento sistólico posterior dos folhetos, maior deslocamento de músculo papilar, maior prevalência de MAD e de curling, bem como insuficiência valvar mais significativa (33% x 7% ≥ moderada).
Houve uma relação direta entre fibrose e gravidade da regurgitação mitral.
O strain mostrou PSI e dispersão mecânica significativamente maiores no segmento basal da parede ínfero lateral dos pacientes com fibrose em relação àqueles sem fibrose miocárdica.
Tanto o PSI quanto a dispersão mecânica não foram significativamente diferentes nos pacientes com PVM sem fibrose miocárdica e no grupo controle.
Um padrão anormal do strain longitudinal foi observado em um subgrupo de pacientes com PVM (47%), caracterizado pelo padrão de “duplo pico”. A prevalência deste padrão foi maior nos pacientes com PVM e fibrose em comparação com os pacientes com PVM sem fibrose.
Na análise multivariada, fibrose miocárdica se associou, de forma independente, com a gravidade da insuficiência mitral, dispersão mecânica e o padrão de “duplo pico” pelo strain.

Comparando pacientes com PVM + fibrose e pacientes sem PVM, mas com fibrose miocárdica em mesma localização, o strain longitudinal não mostrou o padrão de “duplo pico” no grupo não-PVM, apesar de um valor global significativamente reduzido.
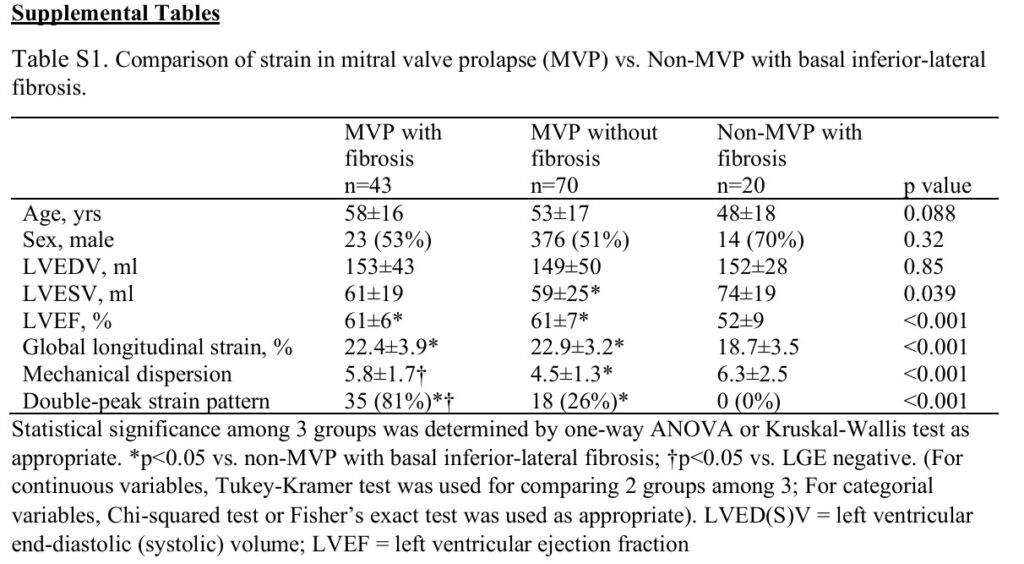
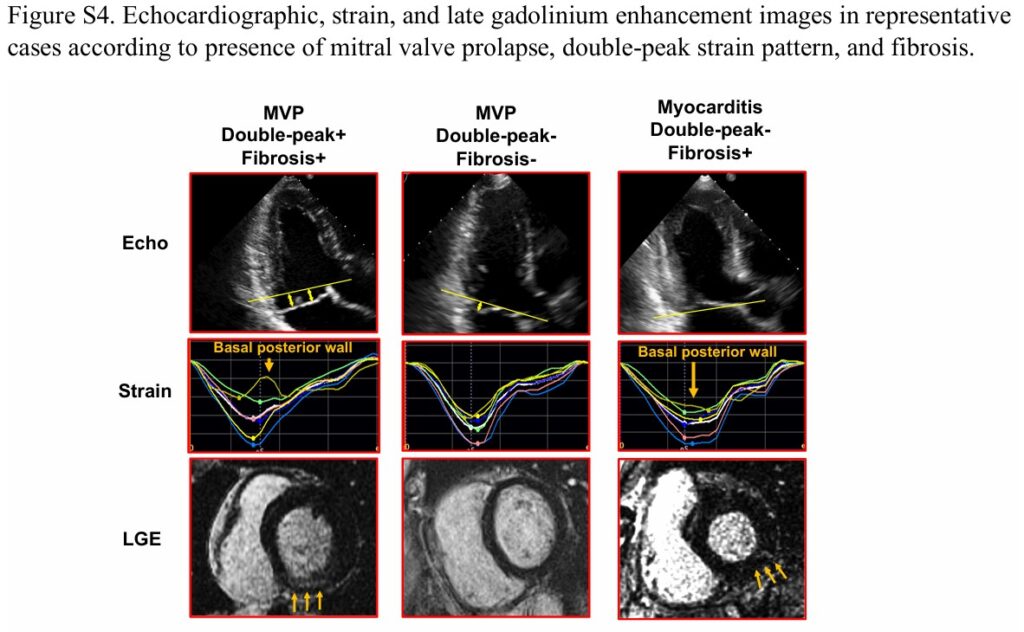
Durante um seguimento médio de 1008 dias, evento arrítmico foi documentado em 36 dos 87 pacientes com PVM com > 6 meses de seguimento, sendo 5 episódios de taquicardia ventricular sustentada e 31 episódios de TVNS. Fibrilação ventricular ou parada cardiorrespiratória não foram documentados.
Os eventos arrítmicos se associaram com (1) fibrose miocárdica, (2) padrão de “duplo pico” pelo strain longitudinal, (3) volumes do VE, (4) magnitude do deslocamento sistólico posterior dos folhetos bem como o (5) deslocamento dos músculos papilares, (6) MAD e (7) PSI do segmento basal da parede ínfero lateral.
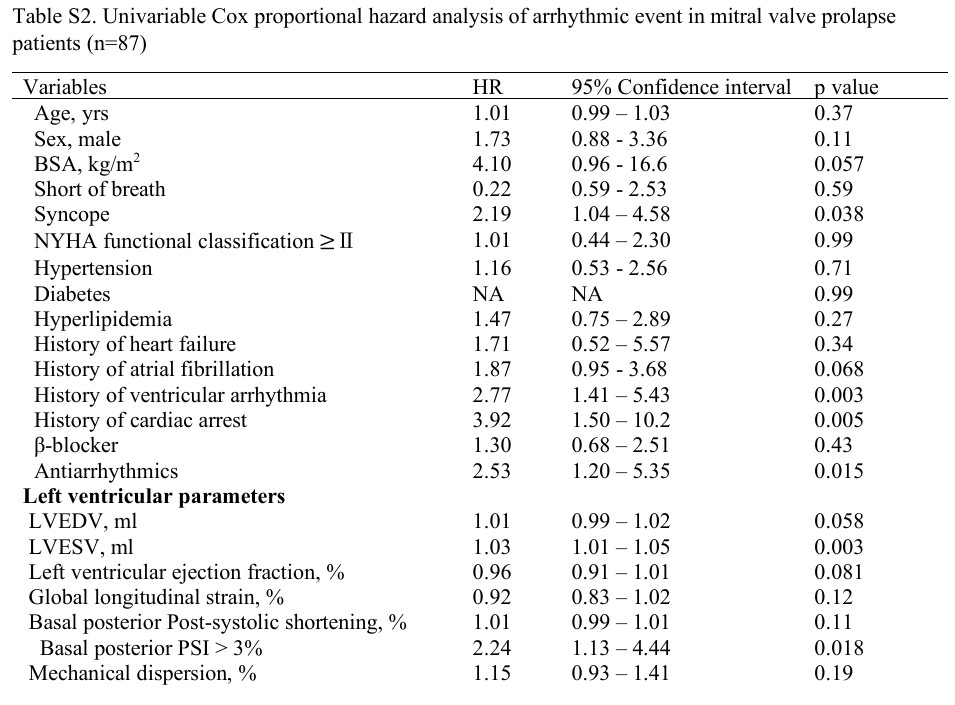
As curvas de sobrevida (Kaplan-Meier) mostraram que a presença de fibrose miocárdica e padrão de “duplo pico” conseguiram diferenciar pacientes com PVM com e sem eventos arrítmicos durante o seguimento.
Na análise multivariada, o padrão de “duplo pico” se associou, de forma independente, com eventos arrítmicos.
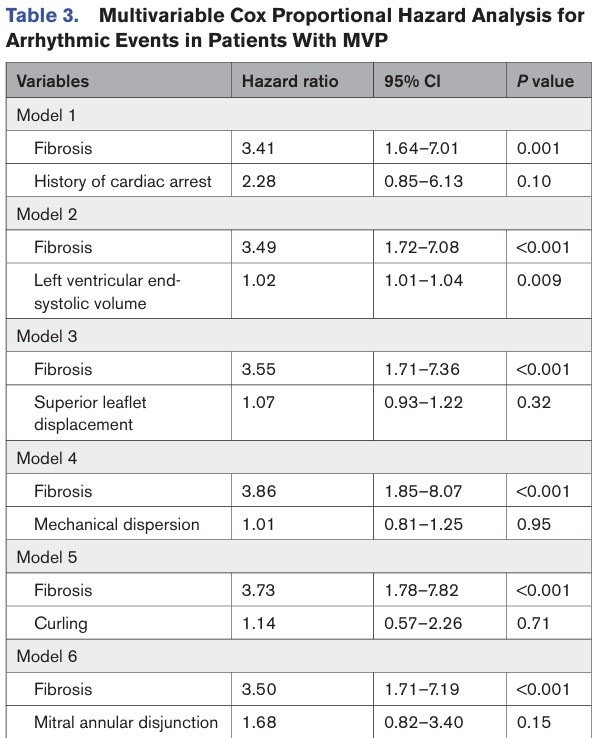
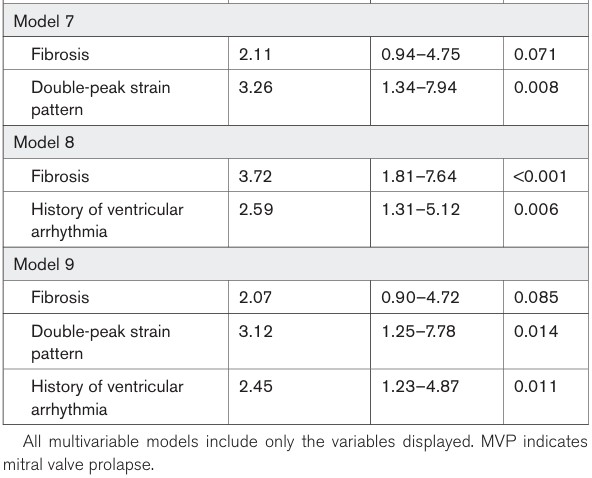
As outras variáveis, com exceção do volume sistólico final do VE, perderam seu impacto significativo em relação aos eventos arrítmicos após ajuste pela fibrose miocárdica.
O padrão de “duplo pico” manteve sua associação significativa independente com eventos arrítmicos após ajuste para história de episódios de arritmia ventricular (HR 3.12, 95%IC: 1.25 – 7.78, P = 0.014).
Os eventos arrítmicos em pacientes sem fibrose miocárdica mostraram relação significativa com o padrão “duplo pico”.
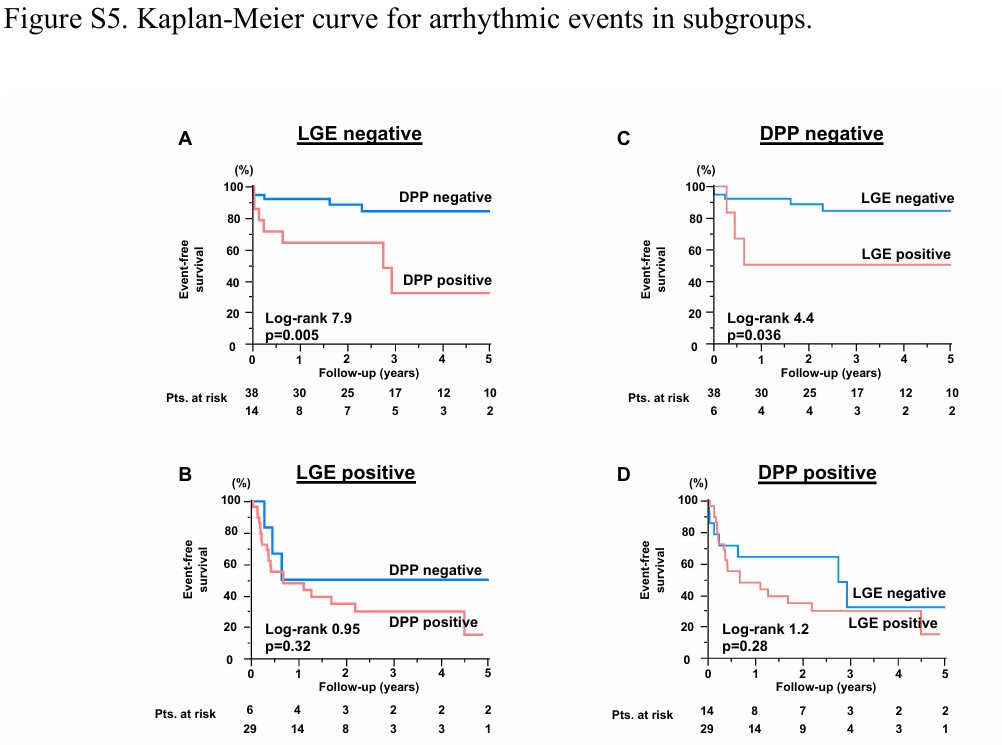
Os achados principais, portanto, são (1) que a mecânica cardíaca anormal na presença de PVM, com diminuição segmentar do strain longitudinal, ocorre no segmento basal da parede ínfero lateral, (2) com o achado do padrão de “duplo pico” (3) se associando significativamente com fibrose miocárdica e (4) conferindo maior risco arrítmico nesses pacientes quando comparado com a presença isolada de fibrose.

Graduado em medicina pela Universidade Potiguar (UnP). Possui residência em Clínica Médica pelo Hospital Universitário Onofre Lopes – HUOL (UFRN) e em Cardiologia pelo Procape – UPE. Porta o título de especialista em Cardiologia pela Sociedade Brasileira de Cardiologia (SBC) e é pós-graduado em Ecocardiografia, pela ECOPE.